"Tai-Chi" in der Zelle
Anzeigen
Proteine – die universellen "Arbeitspferde" aller Zellen – sind nur dann funktionsfähig, wenn bei ihrer Herstellung die Aminosäuren genau nach Bauplan aneinandergefügt werden. Fehler in der Protein-Produktion können fatale Folgen haben und zu schweren Erkrankungen wie Krebs führen. Die "Proteinfabriken" der Zelle sind die Ribosomen. Forscher des Max-Planck-Instituts (MPI) für biophysikalische Chemie Göttingen, der Universität Göttingen und des Forschungszentrums Jülich haben erstmals mit atomarer Genauigkeit sichtbar gemacht, wie das Ribosom auf ein Signal hin zuverlässig die korrekte Aminosäure in Proteine einbaut.
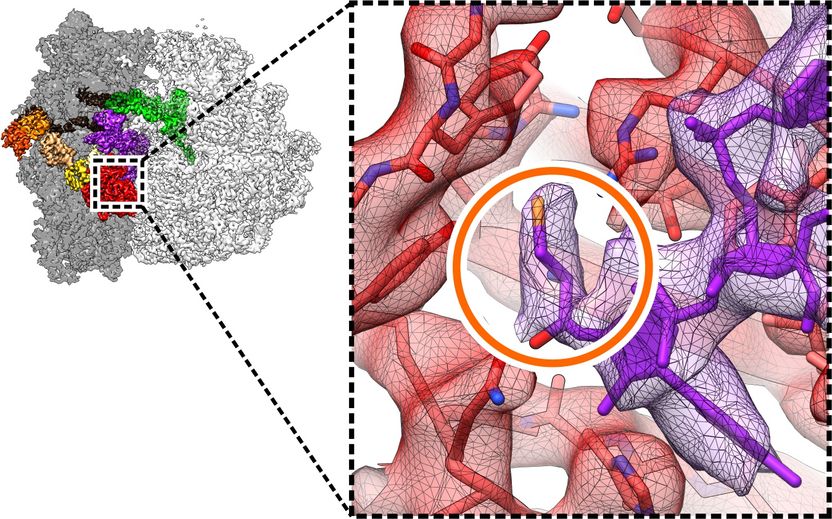
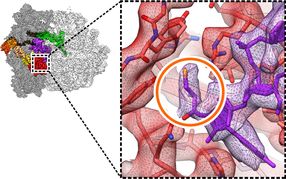
Proteinfertigung mit atomarer Präzision: Die zelluläre Proteinfabrik, das Ribosom (links), baut die lebenswichtige Aminosäure Selenocystein (oranger Kreis) mithilfe des Helferproteins SelB (rot) in Proteine ein.
Copyright: Niels Fischer / Max-Planck-Institut für biophysikalische Chemie
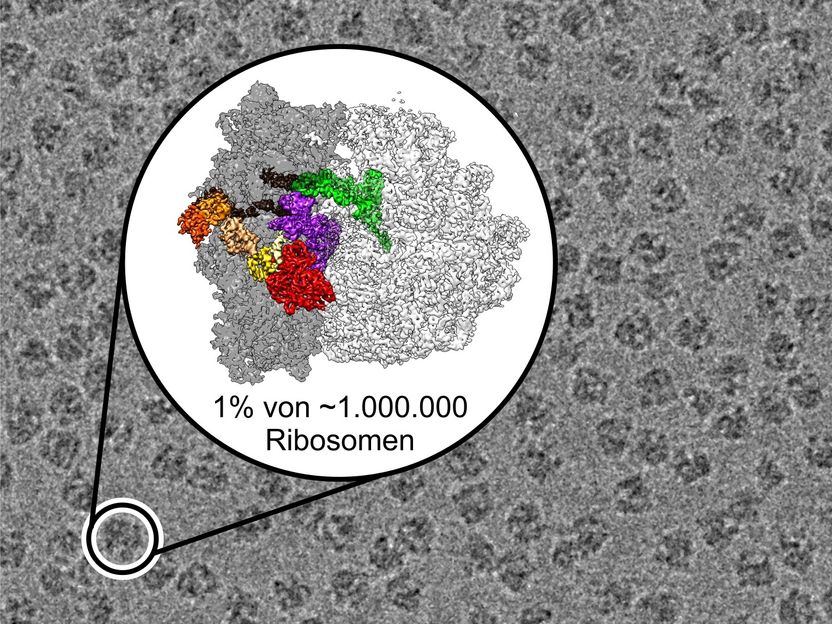
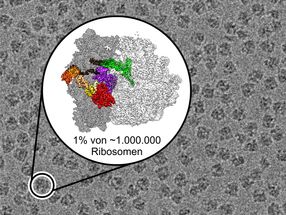
Die Nadel im Heuhaufen – Mittels neuester Methoden der sogenannten Kryo-Elektronenmikroskopie konnten die Wissenschaftler auch sehr seltene, kurzlebige Strukturen der Proteinfabrik visualisieren und somit den komplexen Bewegungsablauf dieser Maschine mit atomarer Genauigkeit verfolgen.
Copyright: Niels Fischer / Max-Planck-Institut für biophysikalische Chemie
Um Proteine herzustellen, erzeugt die Zelle zunächst eine Arbeitskopie des entsprechenden Gen-Abschnitts der DNA – die sogenannte Boten-RNA. Das Ribosom produziert dann genau nach dieser Vorlage eine Kette von verschiedenen Aminosäuren, die zusammen ein neues Protein bilden. Nach dem Schlüssel-Schloss-Prinzip wird fortlaufend je einem Codon der Boten-RNA das passende Gegenstück eines Aminosäuretransporters (auch Transfer-RNA oder tRNA genannt) zugeordnet, der eine bestimmte Aminosäure anliefert. Eine entscheidende Rolle spielt dabei ein Energiespeichermolekül namens GTP. Wird es gespalten, ist das der Startschuss dafür, eine Aminosäure in die Kette einzubauen.
Bislang war unbekannt, wie das Signal, dass der richtige Aminosäure-Transporter am Kettenende angedockt hat, im Ribosom weitergeleitet wird. Offen war auch die Frage, wie das Signal an anderer Stelle im Ribosom bewirkt, dass GTP gespalten und damit die Aminosäure in das Protein eingebaut wird.
Die beteiligten Wissenschaftler, zu denen auch Jun.-Prof. Gunnar Schröder vom Jülicher Institute of Complex Systems gehört, konnten jetzt erstmals offenlegen, wie der Mechanismus auf molekularer Ebene arbeitet. Sie nutzten dazu die Aminosäure Selenocystein. Die Forscher zeigten mithilfe von Kryo-Elektronenmikroskopie und Computersimulationen, wie Selenocystein in einem ersten Schritt zusammen mit einem Helferprotein an das Ribosom geliefert wird. Wenn dann die Aminosäure den korrekten Platz in der Kette gefunden hat, ändert das Ribosom in einer kontrollierten Bewegung – die Forscher verglichen sie mit Tai Chi – seine Struktur. Dadurch wird das Helferprotein am Ribosom so verschoben, dass es die Spaltung des GTP auslösen kann. Das Ribosom erhält damit das Signal, Selenocystein in die Kette von Aminosäuren und damit das neue Protein einzubauen.
Die Wissenschaftler gehen nun davon aus, dass die Signalweiterleitung nicht nur bei Selenocystein so funktioniert. Weitere Experimente deuten darauf hin, dass es sich um einen universellen Mechanismus handelt, nach dem das Ribosom Aminosäuren zu Proteinen zusammensetzt.