Haltlose Zellen: Ursache für schwerwiegende Erbkrankheit aufgedeckt
Mausmutante lieferte den entscheidenden Hinweis
Anzeigen
Unablässig strömen weiße Blutkörperchen auf der Suche nach Krankheitserregern durch unsere Blutgefäße - um eine Immunreaktion auszulösen müssen sie diese aber verlassen und in das infizierte Gewebe eindringen. Bei Patienten, die unter der Erbkrankheit LAD III (Leukozytenadhäsionsdefizienz III) leiden, ist ihnen dieser Weg versperrt. Die Ursache des Defekts klärten nun Forscher des Max-Planck-Instituts für Biochemie gemeinsam mit Wissenschaftlern der LMU München und des Cancer Research UK London Research Instituts auf: Damit sich Leukozyten an Blutgefäßwände anheften können, ist das Protein Kindlin-3 notwendig - fehlt es, ist eine Auswanderung der Leukozyten ins Gewebe nicht möglich.
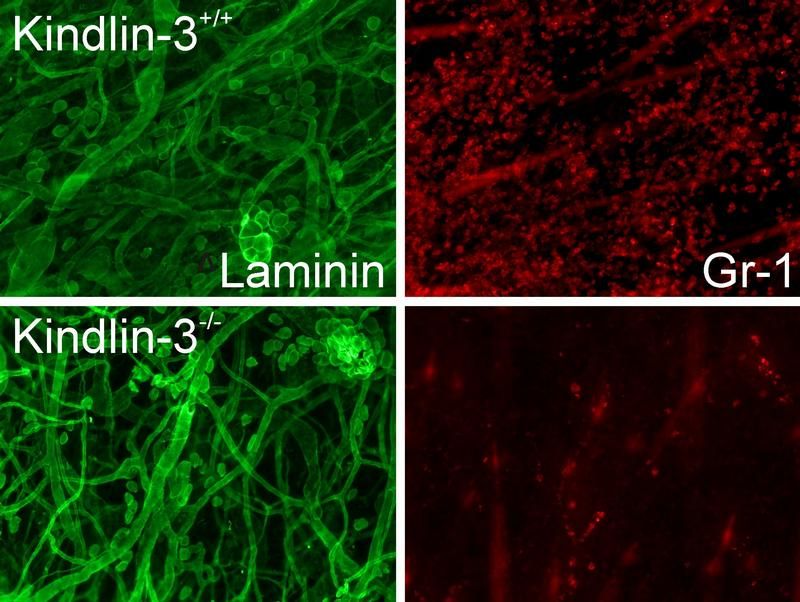
Blutgefäße (grün) und Leukozyten (rot) in entzündetem Gewebe mit Kindlin-3 (oben) und ohne Kindlin-3 (unten). Normale Leukozyten sind nach kurzer Zeit in das infizierte Gewebe eingewandert (oben rechts), während ihnen das in Abwesenheit von Kindlin-3 nicht gelingt (unten rechts).
M. Moser, MPI für Biochemie
Weiße Blutkörperchen (Leukozyten) sind Zellen des Immunsystems, zu deren Aufgabe es gehört, Krankheitserreger abzuwehren. Die Nutzung der Blutgefäße als Transportwege ermöglicht ihnen einerseits, größere Bereiche des Körpers schnell nach Krankheitserregern abzusuchen. Andererseits stehen sie dadurch vor einem prinzipiellen Problem: Infektionen entstehen meistens nicht in den Blutgefäßen, sondern in den umliegenden Geweben. Sie müssen also die Blutgefäße an der richtigen Stelle verlassen, um die Krankheitserreger zu bekämpfen. Auf der Suche nach Anzeichen für Infektionen rollen die Leukozyten an den Zellen der Gefäßwand (Endothelzellen) entlang und nehmen mit diesen zunächst nur losen Kontakt auf. Werden sie durch Signalstoffe auf den Endothelzellen alarmiert, docken sie fest an die Gefäßwand an und quetschen sich anschließend ins umliegende Gewebe durch.
Eine wesentliche Rolle spielen dabei sogenannte Integrine, eine Familie von Proteinen, die auf der Oberfläche von nahezu allen Zellen vorhanden ist. Ein Team von Wissenschaftlern der Abteilung "Molekulare Medizin" am Max-Planck-Institut für Biochemie untersucht unter der Leitung von Reinhard Fässler seit einiger Zeit diese Proteine. Damit Leukozyten aus den Blutgefäßen ins Gewebe einwandern können, müssen sie an der Gefäßwand "den Anker werfen" und zum Stillstand kommen, indem die Integrine als "Ankermoleküle" aktiviert werden. Funktioniert das Anheften an die Gefäßwand nicht, werden die Zellen vom Blutstrom weitergezogen. "Für die korrekte Funktion von Leukozyten und Blutplättchen ist die Integrin-Aktivierung ein zentraler Vorgang", erklärt Max-Planck-Forscher Markus Moser.
Schwere Infektionen und die Neigung zu Blutungen sind typische Symptome der seltenen rezessiv vererbten Krankheit LAD III. LAD III wird durch eine Genmutation verursacht, aufgrund derer die Leukozyten nicht an die Gefäßwand andocken können. Zwar sind die Integrine auf der Oberfläche der Leukozyten von LAD III Patienten vorhanden, aber diese können nicht aktiviert werden. Welcher Gendefekt für diesen Fehler verantwortlich ist, war bisher völlig unklar. Die Max-Planck-Forscher beschäftigen sich mit Proteinen, die die Aktivierung von Integrinen regulieren. Besonders interessant ist dabei das Protein Kindlin-3, das direkt an Integrine bindet. In Zusammenarbeit mit Wissenschaftlern der Ludwig-Maximilans-Universität München (LMU) und des Cancer Research UK London Research Instituts konnten sie nun belegen, dass Kindlin-3 für die Integrin-Aktivierung tatsächlich von zentraler Bedeutung ist: Verhinderten Moser und seine Mitarbeiter die Bildung von Kindlin-3 bei Mäusen, konnten sich die Leukozyten nicht mehr an die Zellwand anheften um in entzündetes Gewebe einzuwandern und die Mäuse zeigten zudem vermehrt Blutungen. "Unsere Ergebnisse an den Kindlin-3 Mäusen gaben den entscheidenden Hinweis darauf, dass Mutationen im Kindlin-3 Gen für die Erbkrankheit verantwortlich sein müssen", erklärt Moser. Dies gilt auch für den Menschen: Wissenschaftler des Cancer Research UK London Research Instituts zeigten, dass alle LAD III Patienten Mutationen im Kindlin-3-Gen tragen. In Zusammenarbeit mit Moser und dem Doktoranden Siegfried Ussar bewiesen die britischen Forscher, dass die Zellen der Patienten kein Kindlin-3 bildeten und der Leukozyten-Adhäsionsdefekt durch Einschleusen eines normalen Kindlin-3-Gens repariert werden.
Originalveröffentlichungen: M. Moser et al.; "Kindlin-3 is required for beta2 integrin-mediated leukocyte adhesion to endothelial cells"; Nature Medicine, advanced online publication, 22. February 2009
L. Svensson et al.; "Leukocyte Adhesion Deficiency-III (LAD-III) is caused by mutations in the adhesion protein Kindlin-3"; Nature Medicine, advanced online publication, 22. February 2009