Fix und fertig schon bei der Abreise
Forscher entschlüsseln, wie Proteine in der Zelle gelenkt werden
Anzeigen
Proteine, die in Zellen vielfältige Aufgaben übernehmen, werden oft von ihrem Herstellungsort in der Zelle über größere Distanzen an ihren späteren Wirkungsort transportiert. Eine "Sonderbehandlung" genießen dabei die Proteine, die später in Peroxisomen, bestimmten Zellorganellen, tätig werden: Anders als andere Proteine werden sie fix und fertig in gefaltetem, d.h. funktionsfähigem Zustand befördert. Bochumer Forscher um Prof. Dr. Ralf Erdmann und PD Dr. Wolfgang Schliebs haben diesen Transportprozess jetzt erstmals experimentell analysiert.
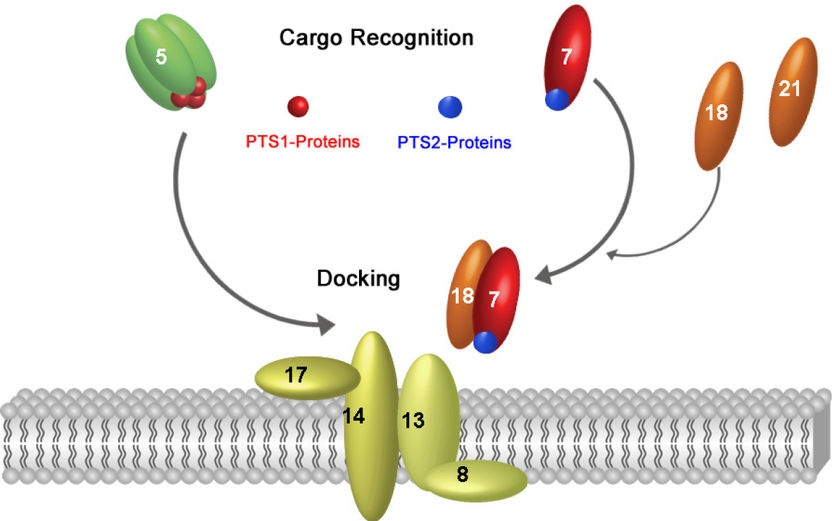
Signalsteuerung beim peroxisomalen Proteinimport von PTS1- und PTS2-Proteinen. PTS1-Proteine werden vom Importrezeptor Pex5p in der Zellflüssigkeit erkannt, gebunden und an den Dockingkomplex der peroxisomalen Membran dirigiert. PTS2-Proteine werden zunächst vonm Importrezeptor Pex7p erkannt, dann erfolgt die Anbindung des Ko-Rezeptors Pex18p, der die Signalsteuerung an den Dockingkomplex ermöglicht. An der peroxisomalen Membran konvergieren die beiden Importwege.
Ruhr-Universität Bochum (RUB)
Weite Wege und Barrieren überwinden
Proteine müssen von ihrem Herstellungsort bis zu ihrem Zielort innerhalb einer Zelle oft größere Distanzen und nicht selten sogar mechanische Barrieren wie Lipidmembranen überwinden. Fehlsortierungen von Proteinen führen häufig zum Funktionsverlust ganzer Zellorganellen, und häufig sogar zum Ausbruch von Krankheiten. Zahlreiche Transportwege sind bekannt. Dabei werden die Proteine in einem ungefalteten, d.h. inaktiven Zustand an ihr Zielorganell befördert - erst die Faltung des Proteins bestimmt seine Funktion. Am Ziel angelangt, werden sie von einem spezifischen Rezeptor erkannt und in das Zielorganell aufgenommen. Erst nach der Aufnahme erreichen sie dann ihren funktionellen Faltungszustand und treten in Wechselwirkungen mit anderen Proteinen.
Peroxisomale Proteine reisen im Verbund
Eine Ausnahme scheinen Proteine zu sein, die für die Peroxisomen bestimmt sind. Peroxisomen sind Zellorganellen, die eine Vielzahl von Stoffwechselaufgaben in der Zelle übernehmen. Sie enthalten über 50 verschiedene funktionelle Eiweiße (Enzyme), deren Zusammensetzung sehr variabel den jeweiligen Bedürfnissen des Organismus angepasst werden kann. Ein wesentliches Charakteristikum von Peroxisomen ist die räumliche Abschottung (Kompartimentierung) von Stoffwechselwegen, bei denen das giftige Wasserstoffperoxid entsteht, dessen Beseitigung eine Hauptaufgabe der Peroxisomen ist. Peroxisomale Proteine gelangen komplett fertig im gefalteten Zustand und häufig sogar im Verbund mit anderen peroxisomalen Proteinen an ihr Ziel.
Lotsen bringen Transportkomplexe ans Ziel
Fehlsortierungen peroxisomaler Proteine haben fatale Folgen: Sie verursachen tödliche Krankheitsverläufe schon im frühen Kindesalter. Schon deshalb beschäftigt sich die Arbeitsgruppe von Prof. Erdmann und Dr. Schliebs mit der Erforschung der Transportwege ins Peroxisom. Eine wesentliche Frage lautet: Wie finden neu synthetisierte Proteine den Weg an die Membran der Peroxisomen und welche Rolle spielen dabei Rezeptoren? Diese Erkennungseinheiten befinden sich teils frei in der Zellflüssigkeit, teils sind sie an die Membran gebunden, teils handelt es sich um so genannte Ko-Rezeptoren. In ihrer aktuellen Studie konnte die Arbeitsgruppe erstmals eine hierarchische Reihenfolge der frühen Ereignisse des Proteinimports in die Peroxisomen zeigen. "Unseren Erkenntnissen zufolge bilden peroxisomale Proteine in der Zellflüssigkeit zunächst mit löslichen Rezeptoren einen Komplex", erklärt Prof. Erdmann. "Erst danach findet die Anbindung der Ko-Rezeptoren statt. Diese enthalten alle notwendigen Zielinformationen und bringen den Rezeptor/Cargo-Komplex zur peroxisomalen Membran." Wenn der Komplex an der Membran angedockt hat, zerfällt er wieder in die einzelnen Bestandteile und die peroxisomalen Proteine werden ins Peroxisom transportiert. "Mit dieser Arbeit konnten wir zum ersten Mal zeigen, dass die Spezifität des Proteintransportes in Peroxisomen nicht erst am Ziel entschieden, sondern bereits in der Zellflüssigkeit festgelegt wird", sagt Prof. Erdmann.
Originalveröffentlichung: Grunau S. et al.; "Peroxisomal targeting of PTS2 pre-import complexes in the yeast Saccharomyces cerevisiae"; Traffic 2009, 10(4):451-60