Wie der Schlüssel das Schloss verändert
Physiologen des Universitätsklinikums Jena schaffen neue experimentelle Grundlagen, um Signalübertragungen an biologischen Rezeptoren zu erforschen
Anzeigen
Ob Maiglöckchen oder Flieder, die Bratwurst auf dem Grill oder das vergessene Stück Käse, das nach Wochen aus der hintersten Ecke des Kühlschrankes wieder auftaucht - alles was duftet, riecht oder stinkt, gelangt in Form von Geruchsmolekülen in unsere Nasen. Dort treffen diese auf die Riechsinneszellen. Über mehrere Hundert verschiedene Arten solcher Sinneszellen verfügt die Nase eines Menschen. Und alle funktionieren nach dem gleichen Prinzip: Die Geruchsmoleküle in der eingeatmeten Luft binden an spezielle Empfangsstationen - so genannte Rezeptoren - auf den Riechsinneszellen. Im Inneren dieser Zellen werden dann Botenstoffe freigesetzt, die wiederum an anderen Rezeptoren in der Zellmembran andocken und ein elektrisches Signal auslösen.
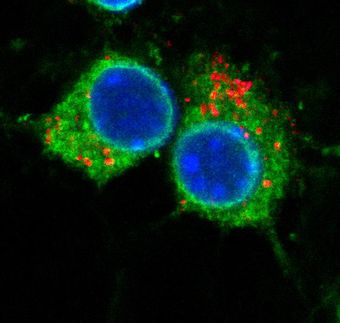
"So wie ein Schlüssel nur in ein bestimmtes Schlüsselloch passt, binden die Botenstoffe nur an bestimmte Rezeptoren", sagt Prof. Dr. Klaus Benndorf von der Friedrich-Schiller-Universität Jena. Doch anders als im Falle eines echten Schlosses, ändert ein Rezeptor nach der Bindung des passenden Botenstoffes seine Form, so als würde der Schlüssel das Schloss verändern. "Erst diese Konformationsänderung löst das Signal aus, das schließlich bis zum Gehirn weitergeleitet wird", erklärt der Direktor des Instituts für Physiologie II des Universitätsklinikums Jena (UKJ). Im Falle der Riechsinneszellen wird ein Kanal geöffnet, durch den bestimmte Ionen die Zellmembran passieren können.
Doch nicht nur unser Geruchssinn arbeitet nach diesem Prinzip der Wechselwirkung zwischen Botenstoff und Rezeptor. "Es handelt sich um ein universelles Prinzip, das in jeder lebenden Zelle vielfach vorkommt", weiß Prof. Benndorf. Ebenso beruht die Wirkung von Hormonen oder Medikamenten darauf, dass sie passgenau an Rezeptoren binden und erst dadurch ihre Wirkung entfalten. "Bisher war es aber unmöglich die Bindungsaffinität von Rezeptoren zu messen, an die bereits Botenstoffe angedockt haben", so Benndorf. Doch genau diese Informationen können Aussagen über die Funktionsweise der Rezeptoren liefern.
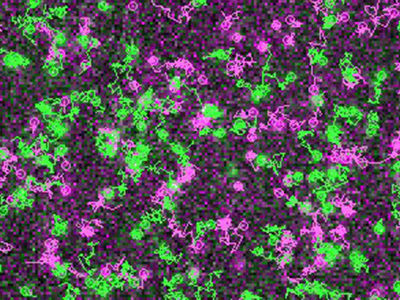
Einem Thüringer Team um Prof. Benndorf ist es jetzt erstmals gelungen, dieses Problem exemplarisch für einen Botenstoff und einen Rezeptor zu lösen. Die grundlegenden Ergebnisse wurden in "Nature" veröffentlicht. Die Physiologen des UKJ haben gemeinsam mit Prof. Dr. Eckhard Schulz von der Fachhochschule Schmalkalden, der Jenaer Dyomics GmbH und zwei weiteren Kooperationspartnern eine Untereinheit des in den Riechsinneszellen vorkommenden Rezeptors und Ionenkanals "live" bei ihrer Arbeit beobachtet. Dazu haben sie Ionenkanäle in Membranen eingebracht und die Bindung eines fluoreszierenden Botenstoffs mit Hilfe eines Mikroskops verfolgt. Parallel dazu haben sie den Strom von Ionen durch die Kanäle in der Membran gemessen. "Auf diese Weise können wir erstmals die Bindungsaffinität des Ionenkanals für den Botenstoff und seine Aktivität gleichzeitig messen", so Prof. Benndorf.
Damit haben die Wissenschaftler des UKJ eine experimentelle Strategie entwickelt, mit der sich grundsätzlich auch die Funktionsweise anderer Rezeptoren untersuchen lassen sollte. Sie planen, dieses Prinzip demnächst an dem Ionenkanal in Herzmuskelzellen anzuwenden, der die Herzfrequenz steuert. Von diesen Experimenten erhoffen sich die Thüringer Wissenschaftler neue Erkenntnisse darüber, wie die Herzfrequenz bestimmt wird, z. B. wenn sie sich bei Aufregung beschleunigt. Prinzipiell bietet sich die neue Methode auch an, erstmals die Wechselwirkung von Medikamenten mit den Rezeptoren genauer zu vermessen und so die Wirksamkeit von Medikamenten besser zu verstehen oder vorherzusagen.