Welche Mutationen wirklich krank machen
Fehlersuche im Erbgut
Anzeigen
Wissenschaftler vom Berlin Institute of Health (BIH) und der Charité – Universitätsmedizin Berlin haben gemeinsam mit Kollegen aus den USA die Steuerbereiche von 20 krankheitsrelevanten Genen gezielt verändert. Dadurch konnten sie diejenigen Veränderungen identifizieren, welche den größten Einfluss auf das Krankheitsgeschehen ausüben. Ihre Ergebnisse ermöglichen nun die Vorhersage, welche bei Patienten gefundenen Veränderungen im Erbgut wirklich verantwortlich für den Krankheitsverlauf sind und sich daher für eine zielgerichtete Therapie eignen.
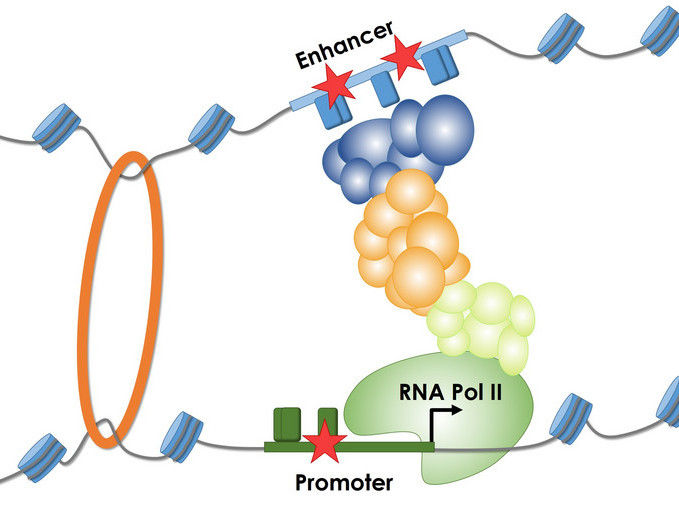
Die Abbildung veranschaulicht das Ablesen eines Genes durch RNA Polymerase II und die Bedeutung von Steuerelementen (Promoter- und Enhancer). Mutationen (Stern) beeinflussen die Bindung verschiedener Proteine und Protein-Komplexe an diesen Promoter und Enhancer-Sequenzen, wodurch die Menge an produzierter RNA verändert werden kann.
© Martin Kircher
Viele Krankheiten entstehen, weil das Erbgut Fehler aufweist, so genannte Mutationen. Diese führen dazu, dass lebenswichtige Eiweißmoleküle nicht korrekt hergestellt werden: Manchmal sind die Moleküle selbst so verändert, dass sie ihre Funktion nicht mehr ausüben können. Häufiger jedoch führen Veränderungen in den Steuerbereichen der Gene (regulatorische Sequenzen, auch Promotoren und Enhancer genannt) dazu, dass die falsche Menge der Eiweiße hergestellt wird. Entweder produziert die Zelle viel zu viel oder viel zu wenig oder gar kein Eiweiß mehr. „Das führt zum Beispiel zu Krebs, wenn ein Eiweiß, das die Zellteilung ankurbelt, in zu großer Menge hergestellt wird“, erklärt Martin Kircher, Leiter der BIH Nachwuchsgruppe Computational Genome Biology und Erstautor der Veröffentlichung.
Doch gerade in Krebszellen treten häufig viele Mutationen auf, von denen manche nichts bewirken, während andere die Krankheit tatsächlich verursachen oder antreiben, indem sie die Produktionsmenge eines Eiweißes beeinflussen. Bevor Ärzte also eine Therapie einleiten, die sich zielgerichtet gegen die Auswirkungen bestimmter Mutationen richtet, sollten sie wissen, wie wichtig diese für das Krankheitsgeschehen ist.
Um hier zu helfen, nahmen sich die Wissenschaftler um Kircher Steuerbereiche 20 krankheitsrelevanter Gene vor und veränderten diese Baustein für Baustein, also Base für Base der DNA. Für diesen Zweck entwickelten sie eine Methode, mit der die Veränderungen in hohem Durchsatz erzeugt und parallel getestet werden konnten. Sie überprüften in der Zellkultur, wie sich die jeweilige Veränderung auf die Eiweißproduktion auswirkte. „Etwa 85% der Veränderungen haben keinen messbaren Effekt, von den verbleibenden 15% reduzieren rund zwei Drittel die Menge des produzierten Eiweißes“, berichtet Kircher. Und es hängt stark von der individuellen Mutation und dem untersuchten Steuerbereich selbst ab, wie intensiv sie das Geschehen in der Zelle beeinflusst: „Wird eine Base gegen eine andere ausgetauscht, hat das meist weniger Einfluss als ein kompletter Wegfall.“
Die untersuchten Steuerelemente stammen von Genen, die bei Patienten mit Krebs, Herzinsuffizienz, erblich bedingtem hohem Cholesterinspiegel oder verschiedenen seltenen Erkrankungen verändert sind. Die Ergebnisse der insgesamt mehr als 30.000 Mutationsanalysen haben die Forscher für jeden frei verfügbar ins Internet gestellt. Martin Kircher hofft nun, dass dieser Datenschatz auch genutzt wird: „Es wäre toll, wenn Ärzte oder Ärztinnen, die bei ihren Patientinnen oder Patienten das Erbgut analysiert haben, in unserer Datenbank nachschauen, welchen Effekt die gefundene Mutation aller Wahrscheinlichkeit nach hat und damit abschätzen können, ob sich die gefundene Veränderung im Patienten möglicherweise für eine zielgerichtete Therapie eignet.“
Ein solcher Aufwand für 20 von möglicherweise Hunderttausenden bis Millionen von Steuerbereichen weckt die Frage, ob sich die Vorhersage, welche Mutation welchen Effekt hervorruft nicht auch mit maschinellem Lernen oder künstlicher Intelligenz vorhersagen ließe. Es existieren bereits verschiedene Computerprogramme, die genau dies versuchen. Kircher und seine Kollegen untersuchten deshalb auch, wie gut verschiedene Programme die in der Zellkultur beobachteten Veränderungen vorhersagen konnten. „Das war leider sehr enttäuschend“, berichtet der Bioinformatiker, „die Vorhersagen stimmten selten mit unseren Beobachtungen überein. Manchmal prognostizierten sie sogar das genaue Gegenteil.“ Die Wissenschaftler hoffen nun, dass ihr Datenschatz möglicherweise auch dazu dienen kann, die Vorhersageprogramme zu verbessern.





















































