Descodificado um promissor medicamento para a doença de Parkinson
Fundação para o desenvolvimento de terapias específicas para a doença de Parkinson e a doença renal crónica
Anúncios
O bom funcionamento do nosso cérebro depende em grande medida do desempenho das nossas células nervosas. É por isso que o seu bom funcionamento é controlado regularmente - os componentes celulares defeituosos são marcados, eliminados e reciclados. Isto inclui as mitocôndrias, as centrais eléctricas das nossas células. Um controlo de qualidade deficiente das mitocôndrias desempenha um papel central na doença de Parkinson. O grupo de investigação liderado por Malte Gersch no Instituto Max Planck de Fisiologia Molecular em Dortmund (MPI) conseguiu agora elucidar o modo de ação de um promissor inibidor da proteína mitocondrial USP30 associada à doença de Parkinson, através da conceção de proteínas quiméricas. Estas descobertas constituem uma base importante para o desenvolvimento de terapêuticas inovadoras contra a doença de Parkinson e outras doenças
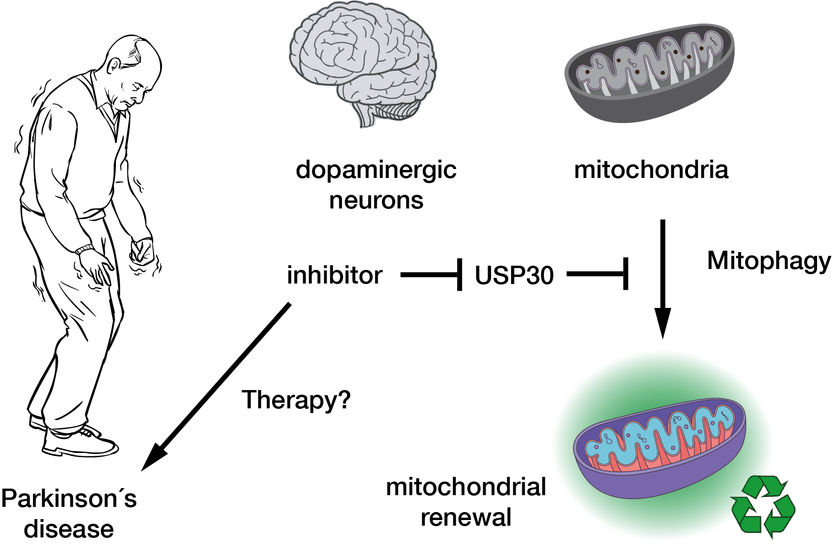
A inibição da deubiquitinase USP30 promove a mitofagia e, consequentemente, a renovação mitocondrial nas células nervosas dopaminérgicas, podendo assim constituir a base de uma terapia inovadora para a doença de Parkinson.
MPI of Molecular Physiology
"Movimentos tremulantes involuntários, combinados com uma força muscular reduzida". Foi assim que o médico britânico James Parkinson descreveu pela primeira vez a doença conhecida como "paralisia por tremor". A doença de Parkinson, que recebeu o seu nome, é a segunda doença neurodegenerativa mais comum depois da doença de Alzheimer. Até à data, não existe um tratamento causal para a síndrome de Parkinson - apenas os sintomas podem ser tratados. A doença é causada por uma perda de células nervosas no tronco cerebral e por uma deficiência associada do neurotransmissor dopamina. Atualmente, existe uma grande esperança no desenvolvimento de novos medicamentos que possam regenerar as células nervosas defeituosas e, assim, contrariar a perda de células nervosas na doença de Parkinson.
Falha no controlo de qualidade das centrais celulares
A causa exacta da morte das células nervosas ainda não é clara. No entanto, há indícios de que os defeitos nas mitocôndrias podem ser responsáveis. As células nervosas, em particular, são altamente dependentes destes organelos, uma vez que necessitam de grandes quantidades de energia. Nas células saudáveis, as mitocôndrias estão sujeitas a um controlo de qualidade constante. Se falharem, são marcadas com a proteína ubiquitina para degradação celular por mitofagia. No entanto, foi recentemente demonstrado que uma marcação incorrecta das mitocôndrias danificadas impede a sua degradação. Isto é causado por certas enzimas-chave da mitofagia, que estão patologicamente alteradas na forma hereditária da doença de Parkinson.
A engenharia de proteínas revela o mecanismo de ação
Uma enzima importante na mitofagia é a deubiquitinase (DUB) USP30. Esta enzima remove as marcas de ubiquitina das mitocôndrias defeituosas que se destinam à degradação. Um inibidor desta enzima, que poderia promover a mitofagia e assim melhorar a função nervosa, está atualmente a ser investigado em ensaios clínicos: é considerado um promissor candidato a medicamento para o tratamento da doença de Parkinson e da doença renal crónica. No entanto, a ação dos inibidores sobre a USP30 ainda não era conhecida a nível molecular. "Um problema com a proteína humana USP30 é o facto de ser difícil de "fotografar" - a sua estrutura molecular é difícil de elucidar. Mas se quisermos ver como o inibidor se liga à proteína, podemos utilizar os raios X para produzir o chamado "padrão de difração" dos dois parceiros num cristal. No entanto, como a USP30 é muito flexível - pode dizer-se que se contorce à frente da câmara - é difícil de cristalizar e a sua estrutura altamente móvel não permite obter uma imagem nítida", explica Malte Gersch, líder do grupo de investigação do MPI. Usando engenharia de proteínas inovadora, Gersch e a sua equipa conseguiram agora obter uma imagem detalhada de como um inibidor se liga ao USP30 e desliga especificamente a sua atividade. Para tal, Nafizul Kazi, estudante de doutoramento do grupo de investigação e primeiro autor do estudo, criou um híbrido de proteínas quiméricas semelhante ao lendário Minotauro: incorporou elementos relacionados de outras proteínas deubiquitinase humanas na USP30, produzindo assim uma variante "fotogénica" da USP30. As imagens de difração obtidas mostram que o inibidor interage com a USP30 de duas maneiras: liga-se a uma região até então desconhecida que só se abre através da interação do inibidor com a proteína e, ao mesmo tempo, a um ponto de acesso que também é acessível a outros inibidores.
Substâncias activas inovadoras contra doenças neurodegenerativas
A elucidação do mecanismo de ação deste potencial medicamento contra a doença de Parkinson não só ajudará a desenvolvê-lo, como também lançará as bases para a conceção de novas moléculas de medicamentos contra a USP30", afirma Gersch. A mitofagia e as enzimas da família DUB desempenham também um papel importante noutras doenças e estão associadas a um sistema imunitário enfraquecido e ao crescimento de tumores. "A nossa nova estratégia de proteínas quiméricas pode ser um verdadeiro fator de mudança para o desenvolvimento de novos inibidores contra as DUBs. Permitir-nos-á decifrar a estrutura de outras proteínas DUB relevantes para a doença em complexo com moléculas, abrindo a possibilidade de desenvolver novos inibidores de ligação específicos para uma vasta gama de doenças", afirma Malte Gersch, olhando para o futuro.
Observação: Este artigo foi traduzido usando um sistema de computador sem intervenção humana. A LUMITOS oferece essas traduções automáticas para apresentar uma gama mais ampla de notícias atuais. Como este artigo foi traduzido com tradução automática, é possível que contenha erros de vocabulário, sintaxe ou gramática. O artigo original em Inglês pode ser encontrado aqui.












































