Decodificato un promettente farmaco per il Parkinson
Fondazione per lo sviluppo di terapie mirate per il morbo di Parkinson e la malattia renale cronica
Annunci
Il buon funzionamento del nostro cervello dipende in larga misura dalle prestazioni delle nostre cellule nervose. Per questo motivo vengono controllate regolarmente per verificarne il corretto funzionamento: i componenti cellulari difettosi vengono contrassegnati, eliminati e riciclati. Questo include i mitocondri, le centrali energetiche delle nostre cellule. L'alterazione del controllo di qualità dei mitocondri svolge un ruolo centrale nella malattia di Parkinson. Il gruppo di ricerca guidato da Malte Gersch presso il Max Planck Institute for Molecular Physiology di Dortmund (MPI) è ora in grado di chiarire la modalità d'azione di un promettente inibitore della proteina mitocondriale USP30, associata al Parkinson, progettando proteine chimeriche. Questi risultati costituiscono una base importante per lo sviluppo di terapie innovative contro il Parkinson e altre malattie.
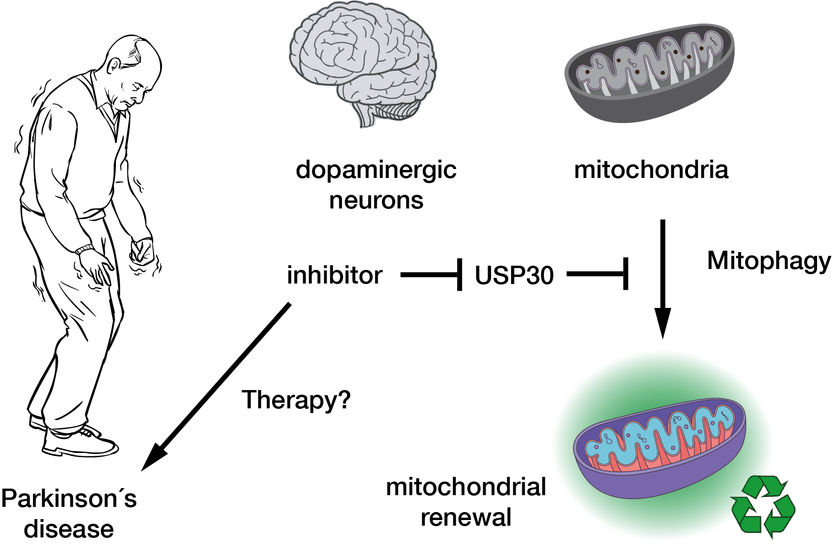
L'inibizione della deubiquitinasi USP30 promuove la mitofagia e quindi il rinnovamento mitocondriale nelle cellule nervose dopaminergiche e potrebbe quindi costituire la base di una terapia innovativa per la malattia di Parkinson.
MPI of Molecular Physiology
"Movimenti involontari tremolanti, combinati con una ridotta forza muscolare". Così il medico britannico James Parkinson descrisse per la prima volta la condizione nota come "paralisi da tremore". La malattia di Parkinson, che porta il suo nome, è la seconda malattia neurodegenerativa più comune dopo l'Alzheimer. Ad oggi, non esiste un trattamento causale per la sindrome di Parkinson, ma si possono trattare solo i sintomi. La malattia è causata da una perdita di cellule nervose nel tronco cerebrale e da un'associata carenza del neurotrasmettitore dopamina. Attualmente si nutrono grandi speranze per lo sviluppo di nuovi farmaci che potrebbero rigenerare le cellule nervose difettose e quindi contrastare la perdita di cellule nervose nella malattia di Parkinson.
Controllo di qualità difettoso delle centrali cellulari
La causa esatta della morte delle cellule nervose rimane poco chiara. Tuttavia, vi sono indicazioni che i difetti nei mitocondri potrebbero essere responsabili. Le cellule nervose, in particolare, dipendono fortemente da questi organelli, in quanto richiedono elevate quantità di energia. Nelle cellule sane, i mitocondri sono soggetti a un costante controllo di qualità. Se falliscono, vengono marcati con la proteina ubiquitina per essere degradati dalla mitofagia. Tuttavia, è stato recentemente dimostrato che una marcatura errata dei mitocondri danneggiati ne impedisce la degradazione. Ciò è causato da alcuni enzimi chiave della mitofagia, che sono patologicamente alterati nella forma ereditaria del morbo di Parkinson.
L'ingegneria proteica rivela il meccanismo d'azione
Un enzima importante nella mitofagia è la deubiquitinasi (DUB) USP30. Rimuove i marchi di ubiquitina dai mitocondri difettosi che sono destinati alla degradazione. Un inibitore di questo enzima, che potrebbe promuovere la mitofagia e quindi migliorare la funzione nervosa, è attualmente oggetto di studi clinici: è considerato un promettente farmaco candidato per il trattamento della malattia di Parkinson e della malattia renale cronica. Tuttavia, il funzionamento effettivo degli inibitori su USP30 non era ancora noto a livello molecolare. "Un problema della proteina umana USP30 è che è difficile da "fotografare": la sua struttura molecolare è difficile da delucidare. Ma se si vuole vedere come l'inibitore si lega alla proteina, si possono usare i raggi X per produrre un cosiddetto "modello di diffrazione" dei due partner in un cristallo. Tuttavia, poiché la USP30 è molto flessibile - si potrebbe dire che si muove davanti alla telecamera - è difficile da cristallizzare e la sua struttura altamente mobile non consente di ottenere un'immagine nitida", spiega Malte Gersch, leader del gruppo di ricerca dell'MPI. Utilizzando un'ingegneria proteica innovativa, Gersch e il suo team sono ora riusciti a ottenere un quadro dettagliato di come un inibitore si leghi a USP30 e ne spenga specificamente l'attività. A tal fine, Nafizul Kazi, dottorando del gruppo di ricerca e primo autore dello studio, ha creato un ibrido proteico chimerico simile al leggendario Minotauro: ha incorporato elementi correlati di altre proteine deubiquitinasi umane nella USP30, producendo così una variante "fotogenica" della USP30. Le immagini di diffrazione ottenute mostrano che l'inibitore interagisce con la USP30 in due modi: si lega a una regione precedentemente sconosciuta che si apre solo grazie all'interazione dell'inibitore con la proteina, e allo stesso tempo a un hotspot accessibile anche ad altri inibitori.
Principi attivi innovativi contro le malattie neurodegenerative
"La delucidazione del meccanismo d'azione di questo potenziale farmaco per il Parkinson non solo aiuterà a svilupparlo ulteriormente, ma getterà anche le basi per la progettazione di nuove molecole farmacologiche contro USP30", afferma Gersch. La mitofagia e gli enzimi della famiglia DUB svolgono un ruolo importante anche in altre malattie e sono associati a un indebolimento del sistema immunitario e alla crescita dei tumori. "La nostra nuova strategia di proteine chimeriche potrebbe essere una vera e propria svolta per lo sviluppo di nuovi inibitori contro i DUB. Ci permetterà di decifrare la struttura di altre proteine DUB rilevanti per la malattia in complessi con molecole, aprendo la possibilità di sviluppare nuovi inibitori specifici per un'ampia gamma di malattie", afferma Malte Gersch, guardando al futuro.
Nota: questo articolo è stato tradotto utilizzando un sistema informatico senza intervento umano. LUMITOS offre queste traduzioni automatiche per presentare una gamma più ampia di notizie attuali. Poiché questo articolo è stato tradotto con traduzione automatica, è possibile che contenga errori di vocabolario, sintassi o grammatica. L'articolo originale in Inglese può essere trovato qui.






































