Décodage d'un médicament prometteur contre la maladie de Parkinson
Fondation pour le développement de thérapies ciblées pour la maladie de Parkinson et les maladies rénales chroniques
Le bon fonctionnement de notre cerveau dépend fortement de la performance de nos cellules nerveuses. C'est pourquoi leur bon fonctionnement est régulièrement contrôlé : les composants cellulaires défectueux sont marqués, éliminés et recyclés. C'est le cas des mitochondries, les centrales électriques de nos cellules. L'altération du contrôle de la qualité des mitochondries joue un rôle central dans la maladie de Parkinson. Le groupe de recherche dirigé par Malte Gersch à l'Institut Max Planck de physiologie moléculaire de Dortmund (MPI) a maintenant réussi à élucider le mode d'action d'un inhibiteur prometteur de la protéine mitochondriale USP30 associée à la maladie de Parkinson en concevant des protéines chimériques. Ces résultats constituent une base importante pour le développement de thérapies innovantes contre la maladie de Parkinson et d'autres maladies.
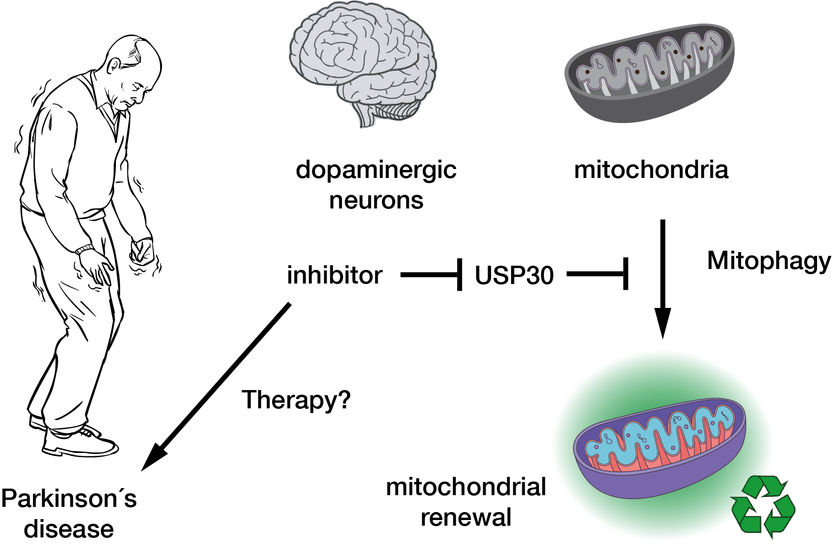
L'inhibition de la déubiquitinase USP30 favorise la mitophagie et donc le renouvellement des mitochondries dans les cellules nerveuses dopaminergiques et pourrait donc constituer la base d'une thérapie innovante pour la maladie de Parkinson.
MPI of Molecular Physiology
"Des mouvements tremblants involontaires, associés à une réduction de la force musculaire". C'est ainsi que le médecin britannique James Parkinson a décrit pour la première fois l'affection connue sous le nom de "paralysie tremblante". La maladie de Parkinson, qui porte son nom, est la deuxième maladie neurodégénérative la plus répandue après la maladie d'Alzheimer. À ce jour, il n'existe pas de traitement causal du syndrome de Parkinson - seuls les symptômes peuvent être traités. La maladie est causée par une perte de cellules nerveuses dans le tronc cérébral et un déficit associé du neurotransmetteur dopamine. Actuellement, il y a de grands espoirs dans le développement de nouveaux médicaments qui pourraient régénérer les cellules nerveuses défectueuses et ainsi contrecarrer la perte de cellules nerveuses dans la maladie de Parkinson.
Contrôle de qualité défectueux des centrales cellulaires
La cause exacte de la mort des cellules nerveuses n'est toujours pas claire. Toutefois, certains éléments indiquent que des défauts au niveau des mitochondries pourraient être à l'origine de ce phénomène. Les cellules nerveuses, en particulier, sont très dépendantes de ces organites, car elles ont besoin de grandes quantités d'énergie. Dans les cellules saines, les mitochondries sont soumises à un contrôle de qualité constant. En cas de défaillance, elles sont marquées par la protéine ubiquitine en vue de leur dégradation cellulaire par mitophagie. Cependant, il a été récemment démontré qu'un marquage défectueux des mitochondries endommagées empêche leur dégradation. Ce phénomène est dû à certaines enzymes clés de la mitophagie, qui sont pathologiquement altérées dans la forme héréditaire de la maladie de Parkinson.
L'ingénierie des protéines révèle le mécanisme d'action
Une enzyme importante de la mitophagie est la déubiquitinase (DUB) USP30. Elle élimine les marques d'ubiquitine des mitochondries défectueuses destinées à la dégradation. Un inhibiteur de cette enzyme, qui pourrait favoriser la mitophagie et donc améliorer la fonction nerveuse, fait actuellement l'objet d'essais cliniques : il est considéré comme un médicament candidat prometteur pour le traitement de la maladie de Parkinson et de l'insuffisance rénale chronique. Cependant, l'action réelle des inhibiteurs sur l'USP30 n'était pas encore connue au niveau moléculaire. "L'un des problèmes de la protéine humaine USP30 est qu'elle est difficile à "photographier" - sa structure moléculaire est difficile à élucider. Mais si vous voulez voir comment l'inhibiteur se lie à la protéine, vous pouvez utiliser les rayons X pour produire ce que l'on appelle un "schéma de diffraction" des deux partenaires dans un cristal. Cependant, l'USP30 étant très flexible - on pourrait dire qu'elle se tortille devant la caméra - il est difficile de la cristalliser, et sa structure très mobile ne permet pas d'obtenir une image nette", explique Malte Gersch, chef du groupe de recherche au MPI. Grâce à une ingénierie protéique innovante, Malte Gersch et son équipe ont pu obtenir une image détaillée de la manière dont un inhibiteur se lie à l'USP30 et interrompt spécifiquement son activité. Pour ce faire, Nafizul Kazi, doctorant au sein du groupe de recherche et premier auteur de l'étude, a créé une protéine hybride chimérique semblable au légendaire Minotaure : il a incorporé à l'USP30 des éléments apparentés à d'autres protéines humaines de la déubiquitinase, produisant ainsi une variante "photogénique" de l'USP30. Les images de diffraction obtenues montrent que l'inhibiteur interagit avec l'USP30 de deux manières : il se lie à une région jusqu'alors inconnue qui ne s'ouvre que par l'interaction de l'inhibiteur avec la protéine, et en même temps à un point chaud qui est également accessible à d'autres inhibiteurs.
Des substances actives innovantes contre les maladies neurodégénératives
L'élucidation du mécanisme d'action de ce médicament potentiel contre la maladie de Parkinson permettra non seulement d'en poursuivre le développement, mais aussi de jeter les bases de la conception de nouvelles molécules médicamenteuses contre l'USP30", explique M. Gersch. La mitophagie et les enzymes de la famille DUB jouent également un rôle important dans d'autres maladies et sont associées à un affaiblissement du système immunitaire et à la croissance des tumeurs. "Notre nouvelle stratégie de protéines chimériques pourrait véritablement changer la donne pour le développement de nouveaux inhibiteurs contre les DUB. Elle nous permettra de déchiffrer la structure d'autres protéines DUB importantes pour la maladie, en complexe avec des molécules, ce qui ouvrira la possibilité de développer de nouveaux inhibiteurs de liaison spécifiques pour un large éventail de maladies", déclare Malte Gersch, en se tournant vers l'avenir.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.





































