Seltene menschliche Darmerkrankung ist auf eine verminderte Proteinsynthese zurückzuführen
Ein Nahrungsergänzungsmittel könnte eine neue Behandlung bieten
Anzeigen
Ein Rückgang der Proteinsynthese in den Zellen des sich entwickelnden Darms trägt zu einer seltenen genetischen Störung bei, und ein preiswertes Nahrungsergänzungsmittel kann dazu beitragen, diesen Rückgang umzukehren. Dies geht aus einer neuen Studie von Yun-Fei Li von der Zhejiang University School of Medicine in Hangzhou, China, und Kollegen hervor, dieam 1. November in der Open-Access-Zeitschrift PLOS Biology veröffentlicht wurde. Das Ergebnis ist ein Fortschritt im Verständnis der Pathogenese der Krankheit und könnte zu neuen Behandlungsmöglichkeiten führen.
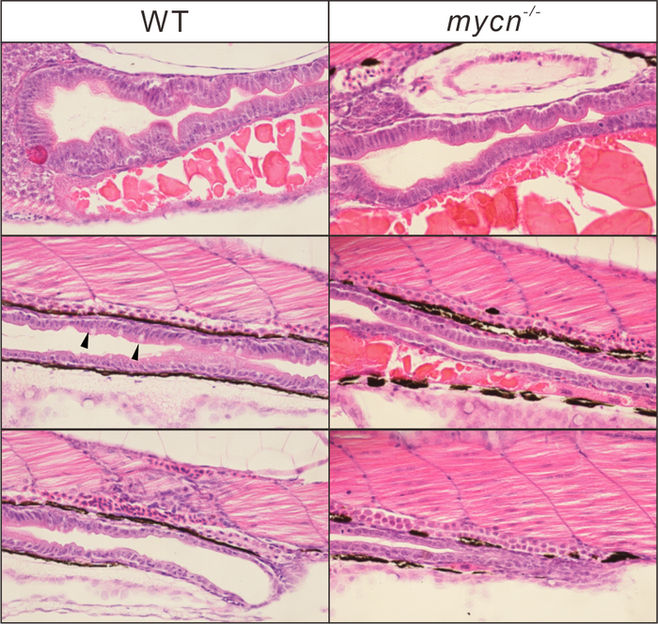
Phänotypische Analyse der Mycn-Mutanten. Morphologie des gesamten Darms, dargestellt mittels HE-Färbung für WT- und mycn-Mutanten-Embryoschnitte bei 4 dpf. Schwarze Pfeile zeigen Becherzellen im WT-Darm an. Die Schnitte wurden entlang der Sagittalebene geschnitten.
Li Y-F et al., 2022, PLOS Biology, CC-BY 4.0
Das Feingold-Syndrom Typ 1 führt zu zahlreichen Entwicklungsstörungen, unter anderem des Skeletts und des Nervensystems, aber das Symptom mit den größten Auswirkungen auf das Leben der Patienten ist die Darmatresie, also die unvollständige Entwicklung des Magen-Darm-Trakts. Die Störung wird durch Funktionsverlust-Mutationen im Gen Mycn verursacht, das für einen wichtigen Transkriptionsfaktor kodiert, der die Aktivität vieler Gene reguliert, aber bisher gab es kein Tiermodell, um die Auswirkungen dieses Verlustes zu untersuchen.
Die Autoren schufen dieses Modell, indem sie CRISPR Genome Editing einsetzten, um einen Teil des Mycn-Gens im Zebrafisch zu löschen, dessen Darmentwicklung große Ähnlichkeiten mit der des Menschen aufweist. Sie stellten fest, dass der daraus resultierende Verlust der Genaktivität zu einer dramatischen Verkleinerung des Darms führte, sowohl in der Länge als auch in der Faltung, die dem Darm seine enorme Oberfläche für die Aufnahme verleiht. In einer besonders betroffenen Untergruppe von Zellen des sich entwickelnden Darms fanden sie eine signifikante Herabregulierung zahlreicher ribosomaler Gene, was zu einer verminderten Gentranslation und Proteinsynthese führte.
Besonders betroffen waren Gene im mTOR-Signalweg, einem zentralen Regulator der Proteinsynthese; die Behandlung von Wildtyp-Zebrafischen mit einem mTOR-Inhibitor rekapitulierte die bei Mycn-Mutanten beobachteten Entwicklungsstörungen des Darms. Als die Autoren die mutierten Fische mit Leucin behandelten, einer Aminosäure, von der bekannt ist, dass sie den mTOR-Signalweg aktiviert, führte dies zu einer teilweisen Normalisierung der Darmgröße bei den Mutanten.
"Unsere Arbeit zeigt, dass die Darmzellen, die sich während der Embryonalentwicklung in einem stark proliferativen Zustand befinden, eine hohe Mycn-Expression benötigen", so die korrespondierenden Autoren Peng-Fei Xu und Xi Jin, "und dass der durch die verringerte Proteinsynthese verursachte Proliferationsstillstand der Hauptgrund für die Entwicklungsdefekte im Darm der Mycn-Mutanten war. Dies deutet auf eine mögliche Behandlungsstrategie für die Darmsymptome bei Patienten mit Feingold-Syndrom Typ 1 hin, obwohl eine Bestätigung in einem menschlichen Darm-Organoid-System unerlässlich ist."
Die Erstautoren Yun-Fei Li und Tao Cheng fügen hinzu: "Das Feingold-Syndrom als Folge eines Mycn-Mangels ist seit Jahrzehnten bekannt, aber der Mechanismus, der zur gastrointestinalen Atresie beim Feingold-Syndrom Typ 1 führt, ist immer noch unklar. Wir haben ein Zebrafischmodell mit Mycn-Mutation entwickelt, das die wichtigsten Phänotypen des Feingold-Syndroms Typ 1 rekapituliert und auch eine mögliche Behandlungsstrategie für das Feingold-Syndrom Typ 1 liefert."
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.