Synthetischer Antikörper ermöglicht erstmals kontrollierbaren „Protein-Knockdown“ in Wirbeltieren
Anzeigen
Wie kleine Kinder nehmen auch Wissenschaftler Dinge gern auseinander, um sie besser verstehen zu können. Die Forschungsgruppen um Dr. Jörg Mansfeld, Forschungsgruppenleiter vom Biotechnologischen Zentrum der TU Dresden (BIOTEC), und Dr. Caren Norden vom Max-Planck-Institut für molekulare Zellbiologie und Genetik (MPI-CBG) haben ein Verfahren zur funktionellen Untersuchung von Proteinen erfolgreich weiterentwickelt. Die Methode des sogenannten Auxin-induzierbaren „Protein-Knockdowns“ wurde so modifiziert, dass fluoreszierende Proteine nicht nur mikroskopisch beobachtet, sondern auch gezielt und innerhalb kurzer Zeit aus Zellen entfernt werden können.
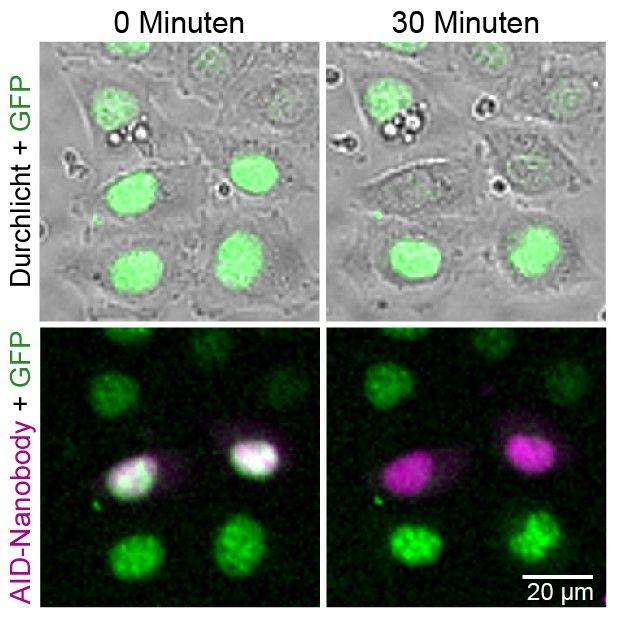
Mikroskopische Aufnahme von lebenden HeLa-Zellen.
Jörg Mansfeld
Vielleicht der wichtigste Grundbaustein aller Zellen sind Proteine, die vielfältigste Funktionen in Zellen und Geweben wahrnehmen. Um die physiologische Rolle solcher Proteine aufzuklären, werden diese oftmals über gezielte genetische Manipulation mit einem grünfluoreszierenden Protein (GFP) verknüpft und so mikroskopisch sichtbar gemacht. Die Beobachtung solcher GFP-verknüpften Proteine in lebenden Zellen erlaubt es Schlüsse zur Funktion des Proteins zu ziehen. Die konkrete Funktion eines Proteins lässt sich aber oftmals erst ermitteln, wenn das Protein entfernt wird und die Konsequenzen in der Zelle, im Gewebe oder im Modellorganismus sichtbar werden.
Dies wird meist durch einen Knockout des Proteins auf der genetischen Ebene erreicht. Proteine mit lebenswichtigen Funktionen können so allerdings nicht ausgeschaltet werden, da in diesem Fall die Zelle oder der Modellorganismus nicht lebensfähig sind. Hier müssen Verfahren angewandt werden, in denen Proteine nur gezielt zu einem konkreten Untersuchungszeitpunkt in den Zellen entfernt werden. Solch ein zielgerichteter vorübergehender Abbau von Proteinen kommt in Pflanzen durch das Pflanzenhormon Auxin vor. Der zugrundeliegende Mechanismus lässt sich nach genetischer Manipulation auch in tierischen und menschlichen Zellen anwenden.
Um GFP-verknüpfte Proteine in lebenden Zellen nicht nur beobachten, sondern auch zielgerichtet rasch abbauen zu können, wurde in der Forschungsgruppe um Dr. Jörg Mansfeld ein neuartiger AID-Nanobody entwickelt. Dazu wurde die Auxin-Erkennungssequenz (AID) mit einem GFP erkennenden Antikörper, wie er in kamelartigen Tieren vorkommt (Nanobody), verknüpft. Es konnte gezeigt werden, dass dieser sogenannte AID-Nanobody bei Zugabe von Auxin innerhalb von Minuten bis wenigen Stunden den nahezu vollständigen Abbau von GFP-verknüpften Zielproteinen in menschlichen Zellen erlaubt. Die Möglichkeit, den Abbau des Proteins dazu „live“ am Mikroskop zu verfolgen, erleichtert die funktionelle Analyse ungemein.
In Zusammenarbeit mit der Arbeitsgruppe von Dr. Caren Norden wurde gezeigt, dass der AID-Nanobody auch erfolgreich im Modellorganismus Zebrafisch eingesetzt werden kann. Durch Anwendung des Verfahrens am Zebrafisch konnte erstmals demonstriert werden, dass ein Auxin-vermittelter „Protein-Knockdown“ auch in komplexen Wirbeltiermodellen umsetzbar ist.
„Unsere Arbeit ist ein exzellentes Beispiel für die Biotechnologie, bei der verschiedene in der Natur vorkommende Prinzipien, wie in unserem Fall das fluoreszierende GFP aus Algen, der Auxin abhängige Proteinabbau aus Pflanzen, und der Nanobody aus Kamelen kombiniert werden, um bisher nicht zugängliche Forschungsfragen beantworten zu können“, sagt Dr. Katrin Daniel aus dem Mansfeld Lab zu den Ergebnissen des Forschungsprojekts.