Durch Biokatalyse: Zugang zu neuen Substanzklassen und Verbindungen
Mannich-Katalysatoren und bicyclische Carbonsäureester mit rPLE synthetisiert
Anzeigen
Der Einsatz von rekombinanten Schweineleberesterasen (rPLE) aus dem Enzymicals-Portfolio ermöglicht die Synthese von neuen, optisch reinen Diastereomeren von substituierten Prolin, welche als anti-Mannich Katalysator eingesetzt werden können. Weiterhin ist eine rPLE der Schlüssel für die erfolgreiche Herstellung eines bisher nicht verfügbaren bicyclischen Carbonsäuresesters mit vier Stereozentren als ein interessantes Intermediat für die pharmazeutische Industrie.

Fotolia
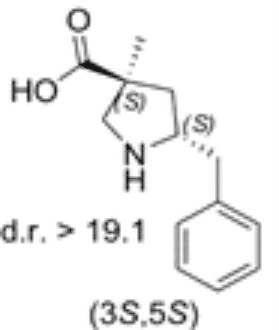
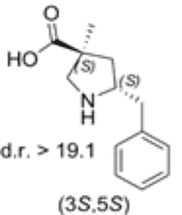
Das 5-Benzyl substituierte (3S,5S)-Cα-methyl-β-prolin
EnzymicalS

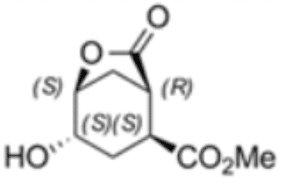
(1R,2S,4S,5S)-4-Hydroxy-7-oxo-6-oxabicyclo [3.2.1]-octan-2-carboxylsäure-methyl-ester
EnzymicalS
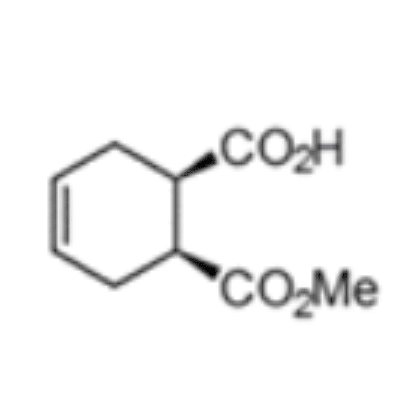
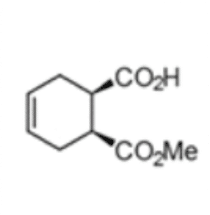
(1S,2R)-1-(Methoxycarbonyl)-cyclohex-4-ene-2-carbonsäure
EnzymicalS

Die asymmetrische Mannich-Reaktion ist eine wichtige Reaktion zur Synthese von ß-Aminocarbonyl-verbindungen unter Knüpfung von Kohlenstoff-Kohlenstoff-Bindungen. Folglich ist der Bedarf an Mannich-Reaktionen, welche selektiv zu anti- oder syn-Produkten mit hoher Enantiomerenreinheit führen, sehr groß. Neben Prolin, welches einen einfachen Zugang zu syn-Produkten ermöglicht, katalysieren Pyrrolidinederivate enantioselektiv die anti-Mannich-Reaktion. Diese sind jedoch wesentlich seltener.
Die Arbeitsgruppe von Professor Masterson (University of Southern Mississippi) hat eine neue Syntheseroute entwickelt, um zwei Diastereomere des 5-Benzyl substituierten Cα-Methyl-β-Prolins in ihrer optisch reiner Form aus Malonsäurediester herzustellen. Dafür kamen rPLE Isoenzyme aus dem Enzymicals Portfolio für die enzymatische Hydrolyse und eine neue stereoselektive Kristallisationsstrategie zum Einsatz.
Beide Diastereomere des neuen Prolin-Derivats wurden dann auf ihre katalytische Aktivität in der Reaktion zwischen α-Imino-ester und Isovaleraldehyd getestet. Das 5-Benzyl substituierte (3S,5S)-Cα-methyl-β-prolin erwies sich als effektiver anti-Mannich-Katalysator.
Das erbrachte Proof-of-Concept bietet weitere Optimierungsmöglichkeiten, sowohl im Bereich der chemo-enzymatischen Synthese des Organokatalysators als auch die endgültige anti-Mannich-Reaktion.
Das zweite Beispiel zeigt die Anwendung eines von Enzymicals entwickelten und bereits maßstabsvergrößerten Verfahrens als Basis für die Herstellung eines bisher nicht verfügbaren Intermediates mit dem chemischen Namen (1R,2S,4S,5S)-4-Hydroxy-7-oxo-6-oxabicyclo [3.2.1]-octan-2-carboxylsäure-methyl-ester. Die vier Stereozentren dieser bicyclischen Verbindung sind eine Herausforderung für die klassisch chemische Synthese. Die Kombination von chemischen und biokatalytischen Reaktionsschritten ermöglicht die Herstellung dieses Methylester-Lactons in optisch reiner Form.
Der chemo-enzymatische Prozess wurde basiert auf der Herstellung von (1S,2R)-1-(Methoxycarbonyl)-cyclohex-4-ene-2-carbonsäure unter Verwendung einer rPLE in einer optimierten enantioselektiven sequentiellen mehrstufigen Eintopfreaktion. Dabei wurde ein optimiertes Veresterungsprotokoll etabliert, ausgehend vom preiswerten Mesoanhydrid und kombiniert mit einer hoch selektiven Desymmetrisierungsreaktion, welche durch die rPLE ECS-PLE06 katalysiert wird. Die enantiomerenreine Verbindung dient als Ausgangsmaterial für die folgende Oxidation und Umlagerungsreaktion, welche dann zu Ringbildung führt. Nach der Optimierung des Prozesses und der Aufarbeitung, ist Enzymicals in der Lage, das neue enantiomerenreine Intermediat im multi-hundert-Gramm-Maßstab herzustellen.
Die Kombination von biokatalytischen mit klassisch chemischen und anderen stereo-selektiven Techniken einen bringt einen wettbewerbsfähigen Vorteil für Ihre Forschung, Entwicklung und Produktion.
Originalveröffentlichung
Kotapati H.K., Robinson J., Lawrence D., Fortner K., Stanford C., Powell D., Wardenga R., Bornscheuer U.; "Diastereoselective hydrolysis of branched malonate diesters by Porcine Liver Esterase: Synthesis of 5-benzyl substituted Cα-methyl-β-proline and catalytic evaluation"; Eur JOC; 2017
Süss P., Borchert S., Hinze J., Illner S., v.Langermann J., Kragl U.m Bornscheuer U.T., Wardenga R.; "Chemoenzymatic Sequential Multistep One-Pot Reaction for the Synthesis of (1S,2R)-1-(Methoxycarbonyl)cyclohex-4-ene-2-carboxylic Acid with Recombinant Pig Liver Esterase"; Org. Process Res. Dev.; 2015