Muttermilch zur Abwehr von Krebs
Anzeigen
An der Universität Graz wurde im Rahmen eines Projekts des Wissenschaftsfonds FWF ein Abwehrpeptid aus Muttermilch so verstärkt und umgebaut, dass es Krebszellen spezifisch aufspüren kann. Der Wirkstoff löst daraufhin den programmierten Zelltod aus. Ein Therapieansatz für schwer behandelbare Krebsformen, der weiter geprüft wird.
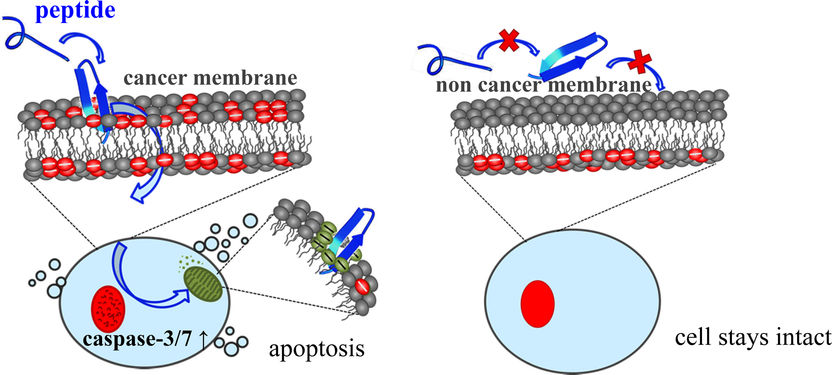
Das Antitumor-Peptid (blau) interagiert mit den negativ geladenen PS-Markern (rot) an der Außenseite der Krebszellmembran. Es wird in die Krebszelle aufgenommen, reagiert mit den Mitochondrien (grün) und löst in weiterer Folge den kontrollierten Zelltod der Krebszelle (Apoptose) aus. Mit der Zellmembran gesunder Zellen kommt es zu keiner Interaktion.
Sabrina Riedl/IMB, Uni Graz
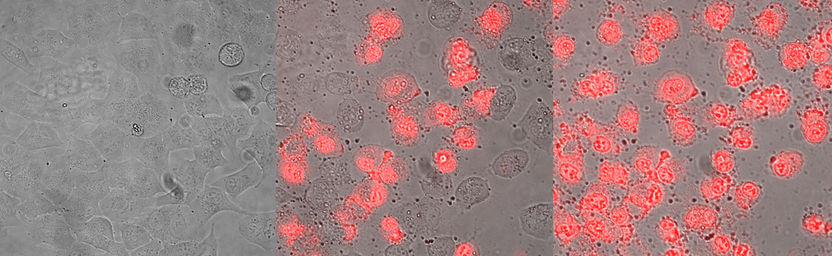
Hautkrebszellen vor (links), nach 4-stündiger (Mitte) und 8-stündiger (rechts) Behandlung mit dem Antitumor-Peptid. In ersten Stufen des ausgelösten Absterbens der Krebszellen erfolgt Bläschenbildung (Mitte), die zunehmende Aufnahme des roten Farbstoffs verweist auf eine starke Membranschädigung und den finalen Zelltod, ausgelöst durch die Peptidbehandlung (rechts).
Sabrina Riedl & Dagmar Zweytick/IMB, Uni Graz
Viele Krebsarten sind gut behandelbar, wenn sie früh erkannt werden und wirksame Chemotherapeutika vorliegen. Als schwer behandelbar gelten hingegen Hautkrebs und Krebs im Gehirn (Glioblastom) sowie Metastasen, also Abkömmlinge eines Tumors, die sich über die Blutbahn im ganzen Körper ausbreiten und einnisten. Aber auch die fieseste Krebszelle hat eine Schwachstelle, eine Achillesferse. Die Membranhülle von Krebszellen trägt im Gegensatz zu gesunden Zellen an der Außenseite negativ geladene Moleküle in Form des Lipids Phosphatidylserin (PS). PS kann also als Krebsmarker dienen. Unterstützt vom Wissenschaftsfonds FWF entwickelte ein Team am Institut für Molekulare Biowissenschaften der Universität Graz eine neue Pfeilspitze, die diese Achillesferse selbstständig anvisiert.
Peptid-Pfeil aus Muttermilch geschnitzt
In einem ersten FWF-Projekt hatte das Team um Dagmar Zweytick bereits herausgearbeitet, dass der Krebsmarker PS sich als Ziel für Antitumor-Medikamente eignet, da er auf diversen Krebsarten und sogar Metastasen nachweisbar ist. In dem vom Wissenschaftsfonds geförderten Folgeprojekt gelang es dem Team nun, ein humanes Abwehrpeptid auf Krebszellen „anzuspitzen“. Ein aktives Teilstück des Peptids Lactoferricin, das in einer Vorstufe in der Muttermilch vorkommt, wurde so umgebaut und verstärkt, dass es unter anderen Melanom- und Glioblastom-Zellen erkennt. Die positiv geladenen Peptid-Pfeile finden die negativ geladene, PS-gespickte Oberfläche von Krebszellen, docken an und lösen binnen Stunden den (zuvor blockierten) programmierten Zelltod aus. Mit gesunden Körperzellen interagieren die Peptid-Varianten hingegen nicht.
Krebszellen killen & Körperzellen schonen
„Die größte Herausforderung im Designprozess war, die richtige Balance von Toxizität und Spezifität zu finden. Wenn die Peptidstücke zu aktiv gestaltet werden, greifen sie auch gesunde Körperzellen an. In Kontrollversuchen haben wir uns immer wieder rückversichert, dass nur Krebszellen gefunden und normale Zellen verschont werden“, erläutern Projektleiterin Dagmar Zweytick und Postdoktorandin Sabrina Riedl im Gespräch mit scilog. Mit Lactoferricin arbeitet die Biophysikerin bereits seit 2002. Das kleine Eiweißmolekül ist in Muttermilch präsent, die das Neugeborene nicht nur mit Nährstoffen, sondern auch einer starken antimikrobiellen Abwehr versorgt. Lactoferricin ist Teil des angeborenen Immunsystems. Es geht als erste Abwehr-Reaktion gegen negativ geladene körperfremde Zellen wie Bakterien und Pilze vor, aber auch gegen veränderte körpereigene Zellen, wie Krebszellen.
Um das Abwehrpeptid als Antitumor-Therapieansatz zu nutzen, musste es jedoch gezielt umgebaut werden. Zwischen Juli 2012 und Juni 2016 arbeitete ein fünfköpfiges Team an der idealen Anordnung der chemischen Bausteine (Aminosäuren) des aktiven Peptid-Teilstücks, das wie eine Haarnadel geformt ist. Im Designprozess wurden zunächst möglichst aktive Formen im Computermodell simuliert. Rund fünfzehn Wirkstoff-Varianten wurden gemäß Bauanleitung synthetisiert und an Membranmodellen und in vitro an Krebs-Zellkulturen getestet.
Tumorschwund im Maus-Modell
In einer Kooperation mit Beate Rinner von der Medizinischen Universität Graz wurden mit den zwei besten Wirkstoffkandidaten In-vivo-Versuche durchgeführt. Verglichen wurden peptidbehandelte und unbehandelte Maus-Xenotransplantate (Mäuse mit humanem Krebsgewebe) und gesunde Kontrollmäuse. In den peptidbehandelten Krebsmäusen zeigte sich ein starker bis vollständiger Rückgang der Tumore um durchschnittlich 85 Prozent beim Melanom bzw. bis zu 50 Prozent beim Glioblastom im Vergleich zu den unbehandelten Krebsmäusen. Eine dritte Gruppe von gesunden Kontrollmäusen trug durch den Wirkstoff keinen Schaden davon. Die Wirkstoff-Varianten wirkten etwa zehnmal stärker als das ursprüngliche Muttermilchpeptid.
Die aktiven Peptid-Varianten mit Antitumorwirkung wurden bereits in der EU und den USA patentiert (bzw. zum Patent eingereicht). Das Team um Dagmar Zweytick arbeitet nun mit einem Pharmaunternehmen im Rahmen eines Projekts der Forschungsförderungsgesellschaft FFG an der Vorbereitung präklinischer Studien. Den neuen Antitumor-Wirkstoff würde man bevorzugt über die Vene spritzen, um auch Metastasen zu erreichen. Es wird also unter anderem getestet, wie stabil der Peptidpfeil im Blutsystem ist, ob ein Durchdringen der Blut-Hirnschranke möglich ist und die Pfeilspitze weiter verstärkt werden kann.
Originalveröffentlichung
Riedl S., Leber R., Rinner B., Schaider H., Lohner K. and Zweytick D.; „Human lactoferricin derived di-peptides deploying loop structures induce apoptosis specifically in cancer cells through targeting membranous phosphatidylserine“; Biochim. Biophys. Acta; 1848 (11) (2015) 2918-2931.
Riedl S., Rinner B., Schaider H., Lohner K. and Zweytick D.; „Killing of melanoma cells and their metastases by human lactoferricin derivatives requires interaction with the cancer marker phosphatidylserine“; Biometals; 27 (5) (2014) 981-997.
Riedl S., Rinner B., Asslaber M., Schaider H., Walzer S., Novak A., Lohner K. and Zweytick D.; "In search of a novel target – Phosphatidylserine exposed by non-apoptotic tumor cells and metastases of malignancies with poor treatment efficacy"; Biochim. Biophys. Acta; 1808 (2011) 2638-2645.

























































