Krebsforschung: Neuer Therapieansatz
Wissenschaftler wollen mutierte Proteine unschädlich machen
Mutierte Proteine ausschalten und so bösartige Tumore bekämpfen – das ist das Ziel des neuen Gemeinschaftsprojektes von Wuppertaler und Bochumer Forschern. Zu diesem Zweck kooperiert die RUB-Arbeitsgruppe Biomolekulare NMR-Spektroskopie von Prof. Dr. Raphael Stoll mit der Wuppertaler Arbeitsgruppe Bioorganische Chemie unter Leitung von Prof. Dr. Jürgen Scherkenbeck. Die Deutsche Krebshilfe fördert das Vorhaben zwei Jahre lang mit 200.000 Euro. „Wir sind davon überzeugt, dass dieses Projekt enorm von der interdisziplinären Zusammenarbeit profitiert“, sagt Stoll.
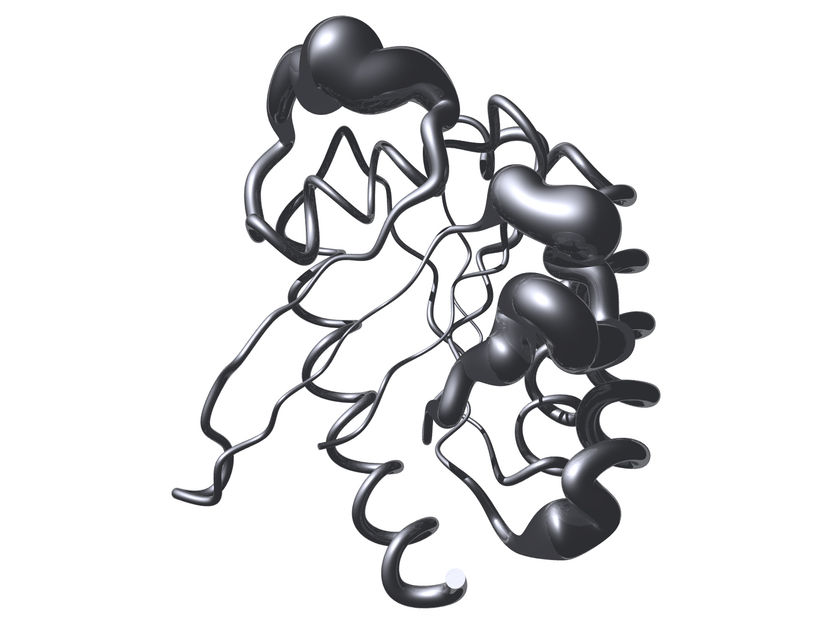
Typisches Strukturmotiv der Ras-Proteine. Verbreitert dargestellt sind vor allem die physiologisch wichtigen sogenannten „switch I“- und „switch II“-Regionen des Proteins.
© Raphael Stoll
Wenn Proteine immer eingeschaltet sind
Allein in Deutschland sterben jedes Jahr mehr als 200.000 Menschen an Krebs; Tendenz steigend. Bösartige Tumore entstehen, wenn Zellen sich unkontrolliert teilen. An diesem hochkomplexen Geschehen sind zahlreiche Proteine beteiligt, die miteinander wechselwirken. Die so genannten Ras-Proteine arbeiten wie molekulare Schalter. Steht der Schalter auf „ein“, leitet Ras Signale von Rezeptoren in der Zellmembran zu Proteinen im Inneren der Zelle. Das kann dazu führen, dass die Zelle wächst oder sich vermehrt. Verschiedene Mutationen bewirken, dass die Ras-Proteine ständig eingeschaltet sind. So senden sie permanent Wachstumssignale, wodurch die Zellen entarten und Krebs entsteht. In Pankreas-Tumoren sind bis zu 90 % eines bestimmten Ras-Proteins mutiert.
Unkontrolliertes Zellwachstum bremsen
Ras-Proteine funktionieren nur, wenn sie in die Zellmembran eingebaut sind. Hierfür ist ein spezieller Teil des Proteins verantwortlich, der von einem bestimmten Enzym (Farnesyltransferase) an Ras angeheftet wird. Die Bochumer und Wuppertaler Forscher arbeiten daran, kleine Rezeptormoleküle herzustellen, die sich an Ras anlagern und so die Stelle blockieren, an der normalerweise der Membran-Anker angefügt wird. Ohne Anker lagert Ras sich nicht in die Membran ein und bleibt ausgeschaltet; das übermäßige Zellwachstum wird gebremst. „Wenn wir Erfolg haben, können wir so ein unbedenkliches Antitumor-Mittel mit großer klinischer Relevanz herstellen“, resümiert Scherkenbeck.
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.