Ein Nilpferd im Fliegenkopf
Wuchernde Stammzellen verursachen Hirntumore
Anzeigen
Maßlosigkeit gilt als Todsünde – auch in der Entwicklungsbiologie. Grenzenloses Gewebewachstum hat fatale Folgen, nämlich die abnorme Vergrößerung von Organen. Deswegen „weiß“ das sich entwickelnde Gehirn der Fruchtfliege Drosophila, wie lange es auf Expansionskurs gehen darf und wann ein Wachstumsstopp notwendig ist.
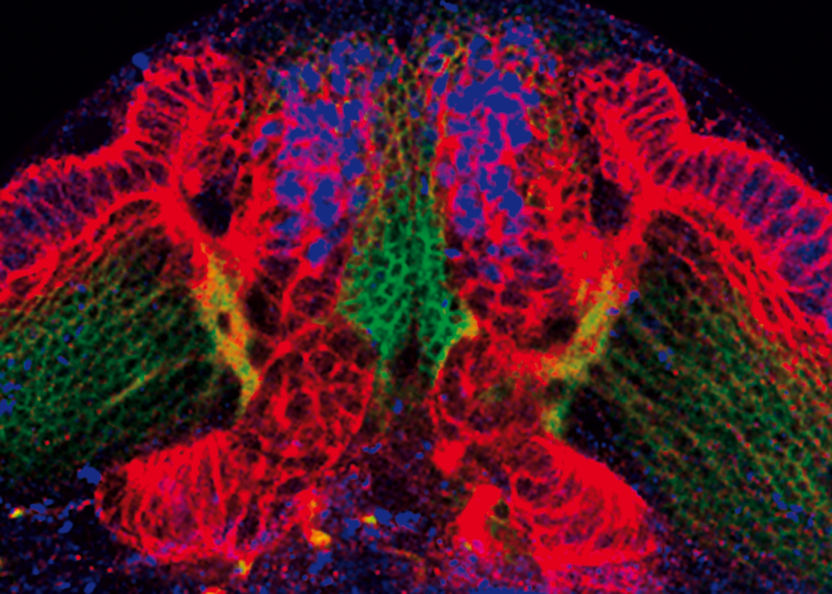
Exzess im Sehlappen: Wenn bei Drosophila-Larven das Protein L(3)mbt fehlt, bilden sich tödliche Hirntumore aus Stammzellen: Zuerst wachsen Neuroepithelien (rot) ohne Kontrolle. Aus ihnen gehen viel zu viele Stammzellen (blau) hervor. Das gesunde Gehirngewebe mit seinen Nervenzellen (grün) wird komplett überwuchert.
IMBA
Ganz anders ist die Situation in Drosophila-Larven, bei denen das Gen l(3)mbt defekt ist. In diesen Mutanten wird kein L(3)mbt-Protein gebildet, Hirntumore wuchern. Zwar formiert sich auch bei diesen Tieren vorerst ein Neuroepithel in den Sehlappen des Gehirns – genau wie bei gesunden Larven. Aus dieser hauchdünnen Zellschicht sollten im Laufe der Entwicklung eine festgelegte Anzahl von Stammzellen sowie spezialisierte Nervenzellen hervorgehen. Letztere sorgen im Gehirn für die Verarbeitung von visueller Information.
Viel zu viele Stammzellen
Doch bei Fliegenlarven ohne L(3)mbt-Protein ist das strikt choreographierte Entwicklungsballett von Grund auf gestört, berichten Postdoc-Forscherin Constance Richter und Senior Scientist Jürgen Knoblich vom IMBA: Das Neuroepithel in den Sehlappen vergrößert sich zuerst extrem. Dann wandelt es sich in neurale Stammzellen (sog. Neuroblasten) um. Diese Zellmasse teilt sich unkontrolliert, und eine Geschwulst entsteht.
Die Folgen für die Fliegenlarven? Zuerst verzögert der aus Stammzellen bestehende Hirntumor „nur“ die Entwicklung. Doch innerhalb weniger Tage breitet er sich fast im ganzen Tier aus. Auch in den Anlagen für die späteren Flügel kommt es zu ungewöhnlichem Wachstum. Schließlich tötet der Tumor die Larve.
Ohne Maß und Ziel
Warum l(3)mbt-Mutanten zu derartiger Maßlosigkeit neigen, war bislang unbekannt. Dabei wollten es Constance Richter und Jürgen Knoblich nicht belassen. Vier Jahre lang untersuchten sie die kranken Fliegenlarven. Schließlich konnten die Forscher u. a. mit biochemischen, epigenetischen und bioinformatischen Methoden nachweisen, dass in den Mutanten der sog. Hippo-Signalübertragungsweg empfindlich gestört ist.
Dieses Informationsnetzwerk ist auch bei Maus und Mensch dafür verantwortlich, dass Organe wie Herz oder Leber ihre „richtige“ Größe einhalten. D. h. gerät der Hippo-Signalübertragungsweg durcheinander, kommt es zu ausuferndem Wachstum bzw. Tumorbildung. Nicht umsonst wurde das – für den Signalübertragungsweg namensgebende – hippo-Gen nach dem wuchtigen Nilfperd (engl. hippo) getauft.
Ordnung muss sein – durch Isolierung
Was passiert im Detail in den Fliegenlarven? Das Protein L(3)mbt ist, wie Richter und Knoblich herausgefunden haben, ein sog. Isolator. Es klammert sich an genau definierte DNA-Abschnitte. Folglich sorgt das Isolator-Protein im gesunden Tier für gezielte Abschirmung – und ein tumorfreies Gehirn. Denn dank Isolierung werden diverse Gene (z. B. yorkie, expanded oder bantam) nur zum richtigen Zeitpunkt ein- und ausgeschaltet sowie exakt stimuliert.
„Ohne das Isolator-Protein wächst das Neuroepithel völlig unkontrolliert. Auch die aus ihm hervorgehenden Stammzellen entziehen sich den äußeren Regulierungssignalen des Körpers. Das ist typisch für Tumore“, fasst Nachwuchswissenschafterin Constance Richter zusammen.
Von der Fliege lernen
Für Studienleiter Jürgen Knoblich sind die neuen Befunde besonders interessant, weil die Bildung des zentralen Nervensystems bei Drosophila und beim Säuger ähnlich verläuft. Die Tumorentstehung in der Fliege sei in Grundzügen durchaus auf den Menschen übertragbar. „Dass man vielleicht eines Tages auch mit Hilfe unserer Ergebnisse Krankheiten heilen kann, ist sehr motivierend“, sagt der Wissenschafter.
Bereits im Jahr 2006 konnte Jürgen Knoblich in einer viel beachteten Arbeit über einen anderen Stammzell-Tumor des Drosophila-Gehirns berichten; er entsteht beim Ausfall des Brat-Proteins. „Tumore von brat-Mutanten und von l(3)mbt-Mutanten sehen im erkrankten Tier gleich aus. Doch der Ursprungsmechanismus ist grundlegend verschieden“, so Knoblich. „Dies ist für Forscher interessant, die Medikamente für Hirntumor-Patienten entwickeln wollen. Möglicherweise sollten Tumore – auch wenn sie anatomisch und histologisch sehr ähnlich sind – aufgrund ihrer andersartigen Entstehungsgeschichte unterschiedlich behandelt werden“, folgert der Experte für Stammzellbiologie.
Tumor-Stammzellen als Krebs-Motor
Dafür, dass entartete Stammzellen nicht nur bei Drosophila fatal sein können, mehren sich den letzten Jahren die Hinweise. Laut Tumor-Stammzellhypothese sind genetisch veränderte Stammzellen (zumindest bei einigen) menschlichen Krebsformen der eigentliche Motor der Krankheit.
Allerdings sind gängige Krebs-Behandlungsformen (Chemotherapie, Bestrahlung) gegen ausdifferenzierte Zellen gerichtet, die sich rasch teilen und die Masse eines Tumors ausmachen. Die viel selteneren und oft lange „schlummernden“ Tumor-Stammzellen werden bei den Standardtherapien nicht nachhaltig attackiert. Dies wird als Ursache für Rückfälle und die Bildung von Metastasen interpretiert. Deswegen versuchen Krebsmediziner, Medikamente speziell gegen die Tumor-Stammzellen zu entwickeln bzw. Wege zu finden, um die entarteten Stammzellen umzuprogrammieren.
Originalveröffentlichung
Constance Richter, Katarzyna Oktaba, Jonas Steinmann, Jürg Müller und Jürgen Knoblich; „The tumor suppressor L(3)mbt inhibits neuroepithelial proliferation and acts on insulator elements“; Nature Cell Biology (advanced online)