Drei goldene Regeln für das Design von neuen Enzymen
Montageanleitung für Enzyme
Anzeigen
In der Biologie haben sich Enzyme über Millionen von Jahren entwickelt, um chemische Reaktionen anzutreiben. Wissenschaftler des Max-Planck-Instituts für Dynamik und Selbstorganisation (MPI-DS) haben nun universelle Regeln abgeleitet, die das de novo-Design optimaler Enzyme ermöglichen. Als Beispiel betrachteten sie die enzymatische Reaktion der Aufspaltung eines Dimers in zwei einzelne Moleküle. Unter Berücksichtigung der Geometrie eines solchen Enzym-Substrat-Komplexes stellten sie drei goldene Regeln auf, die bei der Konstruktion eines funktionsfähigen Enzyms beachtet werden sollten.
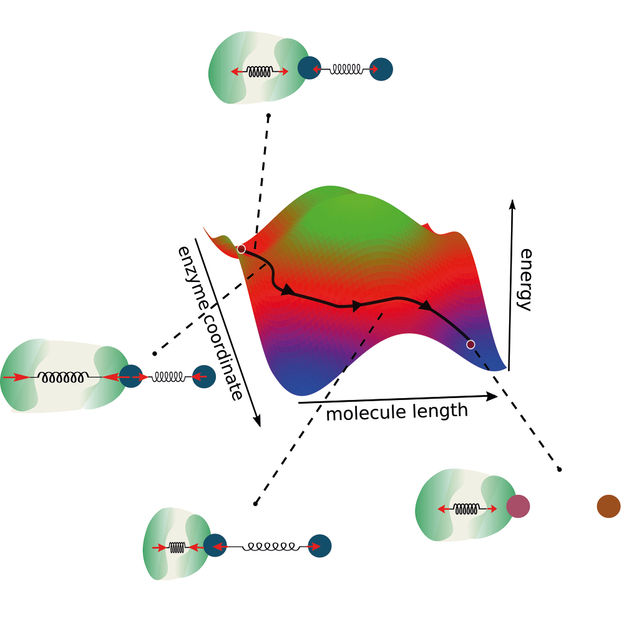
Ein neues Modell zur Beschreibung enzymatischer Reaktionen erweitert die klassische Reaktionskoordinate, indem es die Kopplung zwischen Enzym und Molekül berücksichtigt. Auf diese Weise eröffnen sich neue Möglichkeiten für die Entwicklung neuer Enzyme.
MPI-DS, LMP
Erstens sollte die Schnittstelle zwischen Enzym und Molekül an ihrem jeweils kleineren Ende liegen. Auf diese Weise kann eine starke Kopplung zwischen beiden erreicht werden. Aus dem gleichen Grund sollte die Konformationsänderung im Enzym nicht kleiner sein als in der Reaktion. Schließlich muss die Konformationsänderung des Enzyms auch schnell genug erfolgen, um die chemische Triebkraft der Reaktion zu maximieren.
„Unsere Forschung basiert auf zwei Hauptsäulen“, beschreibt Ramin Golestanian, Direktor des MPI-DS, den Ansatz. „Die Erhaltung des Impulses und die Kopplung zwischen den Reaktionskoordinaten“, fährt er fort. Damit erweiterten die Forschenden die Sichtweise einer klassischen zweidimensionalen Reaktionskoordinate. Typischerweise definieren Modelle für enzymatische Reaktionen eine Energiebarriere, die überwunden werden muss, damit die Reaktion stattfinden kann.
„Da wir in unserem Modell auch die Enzymdynamik und -kopplung berücksichtigen, gehen wir über dieses bestehende Konzept hinaus und betrachten zwei Reaktionskoordinaten“, sagt Michalis Chatzittofi, Erstautor der Studie. „Anstatt eine Energiebarriere zu überwinden, eröffnen sich nun alternative Wege, um diese zu umgehen“, beschreibt er.
Diese Ergebnisse liefern eine neue Grundlage für die Konstruktion molekularer Maschinen. Sie liefern umgehen außerdem den mühsamen und technisch anspruchsvollen Ansatz, für das Design von Enzymen die Dynamik jedes Atoms einzeln zu simulieren.













































