Trois règles d'or peuvent être déduites pour concevoir des enzymes optimisées pour les réactions chimiques
Instructions d'assemblage pour les enzymes
En biologie, les enzymes ont évolué pendant des millions d'années pour piloter les réactions chimiques. Des scientifiques de l'Institut Max Planck pour la dynamique et l'auto-organisation (MPI-DS) ont maintenant dérivé des règles universelles pour permettre la conception de novo d'enzymes optimales. À titre d'exemple, ils ont étudié la réaction enzymatique consistant à casser un dimère en deux molécules monomères. En considérant la géométrie d'un tel complexe enzyme-substrat, ils ont identifié trois règles d'or à prendre en compte pour construire une enzyme fonctionnelle.
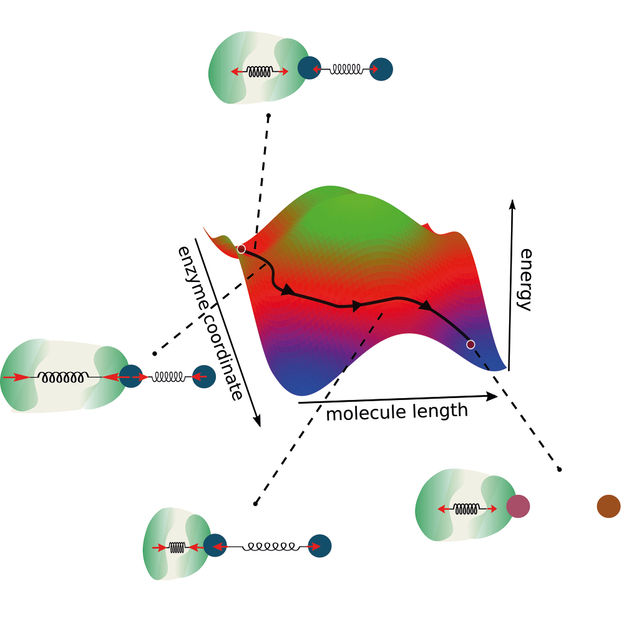
Un nouveau modèle de réactions enzymatiques étend les coordonnées traditionnelles de la réaction en tenant compte du couplage entre l'enzyme et la molécule. De cette manière, des voies alternatives pour les réactions enzymatiques s'ouvrent, ce qui permet de concevoir de nouvelles enzymes optimisées.
MPI-DS, LMP
Premièrement, l'interface de l'enzyme et de la molécule doit être située à leur plus petite extrémité respective. De cette manière, il est possible d'obtenir un couplage fort entre les deux. Pour la même raison, le changement de conformation de l'enzyme ne doit pas être plus faible que celui de la réaction. Enfin, le changement de conformation de l'enzyme doit être suffisamment rapide pour maximiser la force motrice chimique de la réaction.
"Nous avons construit notre recherche sur deux piliers principaux", explique Ramin Golestanian, directeur du MPI-DS, pour décrire l'approche. "La conservation de la quantité de mouvement et le couplage entre les coordonnées de la réaction", poursuit-il. Les chercheurs ont ainsi élargi la vision d'une coordonnée de réaction classique à deux dimensions. En général, les modèles de réactions enzymatiques définissent une barrière énergétique qui doit être surmontée pour que la réaction ait lieu.
"Comme notre modèle prend également en compte la dynamique et le couplage des enzymes, nous allons au-delà de ce concept existant, en considérant deux coordonnées de réaction", explique Michalis Chatzittofi, premier auteur de l'étude. "Au lieu de surmonter une barrière énergétique, on peut désormais imaginer d'autres moyens de la contourner en empruntant d'autres voies", conclut-il.
Ces résultats fournissent une nouvelle base pour la conception de machines moléculaires, en évitant l'approche fastidieuse et techniquement difficile qui consiste à simuler la dynamique de chaque atome individuellement.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.





































