Neuromuskuläres 2D-Modell für die Wirkstoffforschung
Anzeigen
Bei neuromuskulären Erkrankungen ist das Miteinander von Neuronen und Muskelzellen gestört. Forschende um Mina Gouti können es nun auch in einer Kulturschale in 2D nachstellen. Der Ansatz sei gut für Hochdurchsatzscreenings in der Wirkstoffforschung geeignet, schreiben sie in Nature Communications.
Rund 800 verschiedene neuromuskuläre Erkrankungen sind heute bekannt. Diese Krankheiten entstehen durch ein gestörtes Zusammenspiel zwischen Muskelzellen, motorischen Nervenzellen und peripheren Nerven. Diese Störungen führen zu Muskelschwäche, Lähmungen und in einigen Fällen Tod, so etwa bei der Amyotrophen Lateralsklerose oder der Spinalen Muskelatrophie.
„Diese Erkrankungen sind sehr komplex, und die Ursache für die Störung kann an sehr unterschiedlichen Stellen liegen“, sagt Dr. Mina Gouti, Leiterin der Arbeitsgruppe Stammzell-Modellierung der Entwicklung und Erkrankung am Max Delbrück Center. So können die Nerven- oder Muskelzellen, aber auch die Verbindungen zwischen beiden Zelltypen betroffen sein. „Um die Ursachen besser zu verstehen und wirksame Therapien zu finden, benötigen wir daher humane Zellkultursysteme, in denen wir das Zusammenspiel von Motoneuronen des Rückenmarks und Muskelzellen untersuchen können.“
Organoide sind zu groß für Hochdurchsatz-Screenings
Die Forschenden um Gouti haben zuvor bereits ein dreidimensionales neuromuskuläres Organoid-System entwickelt, die NMOs. „Eines unsere Ziele ist es, mit unseren Kulturen Wirksubstanzen im großen Maßstab zu testen“, sagt Gouti. „Die dreidimensionalen Organoide sind recht groß und lassen sich nicht über einen längeren Zeitraum in einer 96-Loch-Kulturplatte züchten, in der wir Hochdurchsatz-Screenings mit Wirkstoffen durchführen können.“
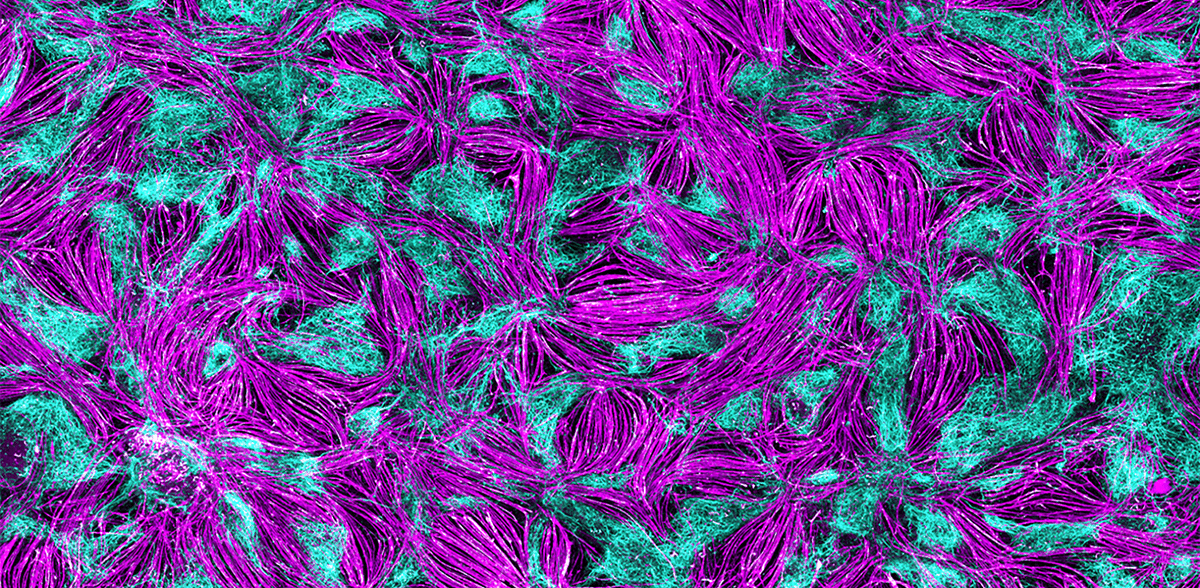
Für solche Screenings hat ein internationales Team um Gouti jetzt erfolgreich ein sich selbst-organisierendes 2D-Zellkultursystem aus pluripotenten Stammzellen entwickelt, das Nervenzellen und Muskelzellen enthält, sowie die chemischen Synapsen, also die neuromuskuläre Verbindung, die das Zusammenspiel zwischen beiden Zelltypen erst ermöglichen.„Mithilfe dieser zweidimensionalen Kulturen können wir im ersten Schritt mögliche Wirkstoffe im Hochdurchsatzverfahren testen und vielversprechende Kandidaten dann in patientenspezifischen Organoiden genauer prüfen“, sagt Gouti.
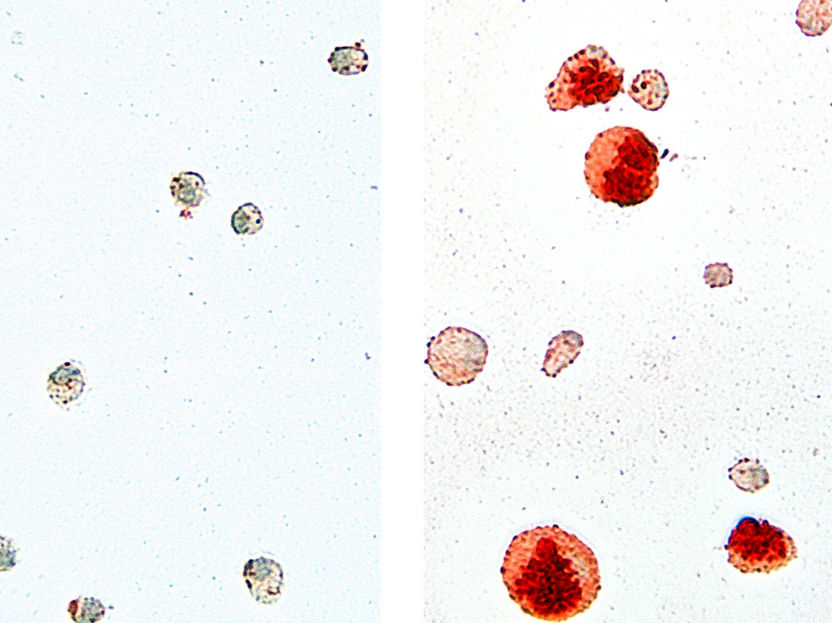
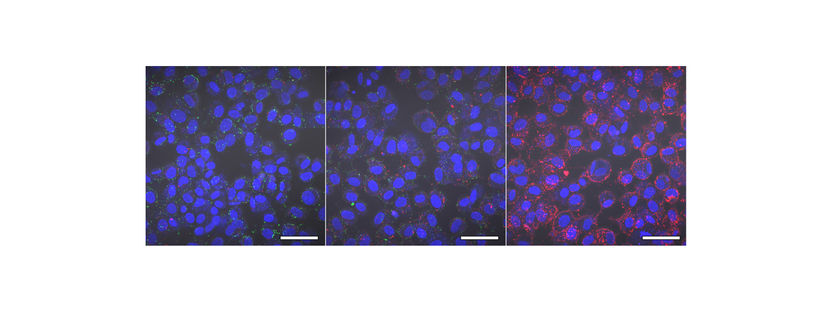
Um das selbst-organisierende 2D-Modell für Neuromuskuläre Verbindungen zu etablieren, galt es zunächst nachzuvollziehen, wie sich Motoneuronen und Muskelzellen im Embryo entwickeln. Minas Team macht selbst keine Embryonenforschung, sondern nutzt verschiedene humane Stammzelllinien, die unter Einhaltung strenger Richtlinien zu Forschungszwecken verwendet werden dürfen, sowie eine induzierte plutipotente Stammzelllinie (iPSC). „Wir haben verschiedene Hypothesen geprüft. Dabei haben wir erkannt, dass die Zelltypen, die wir für funktionale neuromuskuläre Verbindungen benötigen, aus neuromesodermalen Vorläuferzellen entstehen“, sagt Doktorandin Alessia Urzi, Erstautorin der Publikation. Urzi fand die richtige Zusammensetzung aus Signalmolekülen, mit deren Hilfe menschliche Stammzellen zu funktionalen Motoneuronen und Muskelzellen heranreifen sowie Verbindungen zwischen beiden knüpfen. „Es war sehr aufregend, erstmals im Mikroskop zu beobachten, wie die Muskelzellen kontrahieren“, berichtet die Forscherin. „Ein deutlicher Hinweis darauf, dass wir auf dem richtigen Weg sind.“ Eine weitere Beobachtung: Die ausdifferenzierten Zellen organisieren sich selbst zu Bereichen mit Muskel- und Nervenzellen, ähnlich einem Mosaik.
Ein optogenetischer Schalter für die Motoneuronen
Die in der Kulturschale entwickelten Muskelzellen kontrahieren spontan durch ihre Verbindung zu den Nervenzellen, jedoch ohne sinnvollen Rhythmus. Dies reichte Urzi und Gouti nicht aus. In Zusammenarbeit mit Forschenden der Charité – Universitätsmedizin Berlin, nutzten sie die Optogenetik um die Motoneuronen zu aktivieren. Durch einen Lichtblitz angeregt, feuern die Nervenzellen, sodass die Muskelzellen synchron kontrahieren. Sie kommen dadurch einer physiologischen Situation im Organismus noch näher.
Ein Modell für spinale Muskelatrophie
Um ihr Model zu überprüfen, nutzte Ursi humane iPSC von Betroffenen mit spinaler Muskelatrophie, eine schwerwiegende neuromuskuläre Erkrankung, die bei Kindern im ersten Lebensjahr auftritt. In den neuromuskulären Kulturen, die aus diesen patient*innenspezifischen pluripotenten Stammzellen herangereift sind, zeigten sich schwerwiegende Probleme bei der Kontraktion der Muskelzellen – ähnlich wie es in der Muskulatur der Erkrankten der Fall ist.
Für Gouti sind ihre 2D- und 3D-Kulturen wichtige Werkzeuge, um neuromuskuläre Erkrankungen detaillierter zu erforschen und effizientere sowie individualisierte Behandlungskonzepte zu prüfen. Im nächsten Schritt will Gouti mit ihrem Team Hochdurchsatz-Screenings durchführen, um neue Therapiemöglichkeiten für Betroffene mit spinaler Muskelatrophie und amyotropher Lateralsklerose zu finden. „Wir wollen zunächst für bereits zugelassene Wirkstoffe prüfen, ob wir mit neuen Wirkstoff-Kombinationen bessere Behandlungserfolge für Menschen mit komplexen neuromuskulären Erkrankungen erzielen können“, sagt Gouti.
Originalveröffentlichung
Alessia Urzi, Ines Lahmann, Lan Vi N. Nguyen, Benjamin R. Rost, Angélica García-Pérez, Noemie Lelievre, Megan E. Merritt-Garza, Han C. Phan, Gary J. Bassell, Wilfried Rossoll, Sebastian Diecke, Severine Kunz, Dietmar Schmitz, Mina Gouti; "Efficient generation of a self-organizing neuromuscular junction model from human pluripotent stem cells"; Nature Communications, Volume 14, 2023-12-19