„Fingerabdruck“ von Peptiden erlaubt früheren Alzheimer-Nachweis
Trocknungsmuster von Peptid-Lösungen machen effektives Identifizieren von neurodegenerativen Krankheiten möglich
Anzeigen
Neurodegenerative Krankheiten wie Alzheimer oder Parkinson werden durch Fehlfaltungen von Proteinen oder Peptiden hervorgerufen, also durch Änderungen in deren räumlicher Struktur. Ursache sind kleinste Abweichungen in der chemischen Zusammensetzung der Biomoleküle. Forschende des Karlsruher Instituts für Technologie (KIT) haben nun eine effektive und simple Methode entwickelt, die solche Fehlfaltungen bereits in einem frühen Stadium der Erkrankung nachweisen kann. Fehlfaltungen zeigen sich demnach über die Trocknungsstruktur von Protein- und Peptid-Lösungen. Dabei werden mikroskopische Aufnahmen mit neuronalen Netzwerken analysiert, die Vorhersagegenauigkeit liegt bei über 99 Prozent. Die Ergebnisse erschienen in Advanced Materials.
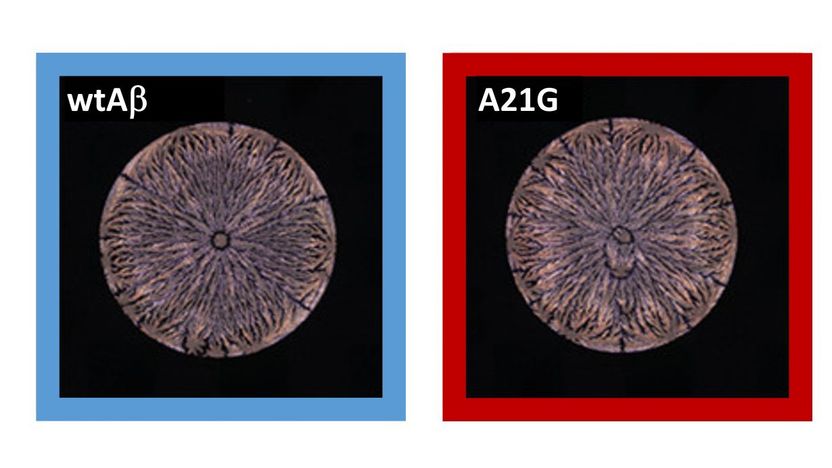
Neuronale Netzwerke erkennen kleinste Unterschiede in den Trocknungsmustern von Peptid-Lösungen (links: Amyloid-beta-(Aβ42)-Peptid, rechts: Mutation).
Karlsruher Institut für Technologie (KIT)
Proteine und Peptide beziehen ihre biologischen Funktionen aus ihrer biochemischen Struktur. Vieles deutet darauf hin, dass selbst kleinste strukturelle oder räumliche Veränderungen die Entwicklung von Krankheiten fördern können. Zahlreiche neurodegenerative Krankheiten sind auf Fehlfaltungen von Peptiden und Proteinen zurückzuführen, die durch solche Änderungen ausgelöst werden. Bei der Alzheimer-Krankheit spielen Amyloid-beta-(Aβ42)-Peptide eine wesentliche Rolle, die sich in einem einzigen Aminosäurerest unterscheiden und vererbbare Mutanten der Alzheimer-Krankheit darstellen.
Bislang fehlte eine einfache und genaue Methode zur Vorhersage von Mutationen in Proteinen. Am Institut für Funktionelle Grenzflächen (IFG) des KIT hat die Forschungsgruppe von Professor Jörg Lahann nun ein Verfahren entwickelt, um Fehlfaltungen über die Trocknungsstruktur von Protein- und Peptid-Lösungen nachzuweisen. „Die Fleckenmuster waren nicht nur charakteristisch und reproduzierbar, sondern führten auch zu einer Klassifizierung von acht Mutationen mit einer Vorhersagegenauigkeit von über 99 Prozent“, beschreibt Lahann, Autor der Studie, die Ergebnisse. Die Gruppe hat gezeigt, dass entscheidende Informationen über die primären und sekundären Peptidstrukturen aus den Flecken abgeleitet werden können, die ihre trocknenden Tröpfchen auf einer festen Oberfläche hinterlassen.
Fleckenmuster als genaue Fingerabdrücke eines Peptids
Dabei werden die Protein- und Peptid-Lösungen mit einem Pipettierroboter präzise auf die Modelloberflächen aufgebracht, um kontrollierte und reproduzierbare Ergebnisse zu erhalten. Diese Oberflächen wurden zuvor mit einer wasserabweisenden Polymerbeschichtung versehen. Um die komplexen Fleckenmuster der getrockneten Tröpfchen zu analysieren, haben die Forschenden Aufnahmen per Polarisationsmikroskopie erstellt. Anschließend wurden diese Bilder mit neuronalen Deep Learning-Netzwerken analysiert.
„Da die Strukturen sehr ähnlich und mit dem bloßen Auge nur schwer zu unterscheiden sind, war es durchaus überraschend, dass die neuronalen Netzwerke so effektiv waren", beschreibt Jörg Lahann die Resultate. „Die Fleckenmuster von Amyloid-beta-Peptiden dienen als genaue Fingerabdrücke, die die strukturelle und räumliche Identität eines Peptides widerspiegeln.“ Diese Technologie ermögliche es, einzelne Alzheimer-Varianten mit maximaler Auflösung zu identifizieren, so Lahann, und das innerhalb weniger Minuten.
Einfache Probenaufbereitung liefert schnelle Diagnose
Die Ergebnisse legen nahe, dass eine so einfache Methode wie das Trocknen eines Tröpfchens einer Peptid-Lösung auf einer festen Oberfläche als Indikator für winzige, aber strukturelle Unterschiede in den Primär- und Sekundärstrukturen von Peptiden dienen kann. „Skalierbare und genaue Nachweisverfahren für die Schichtung von räumlichen und strukturellen Proteinveränderungen sind dringend erforderlich, um die pathologischen Krankheiten wie die Alzheimer- und Parkinson-Krankheit zu entschlüsseln“, sagt der Wissenschaftler. Zudem handelt es sich um eine vergleichsweise simple Methode, die vor allem keine aufwändige Probenaufbereitung erfordert und damit eine einfache und patientennahe Diagnostik ermöglicht. Des Weiteren bietet die Methode auch für andere Anwendungsfelder in der medizinischen Diagnostik und in der molekularen Aufklärung von Krankheiten großes Potenzial.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Diagnostik
Die Diagnostik ist das Herzstück der modernen Medizin und bildet in der Biotech- und Pharmabranche eine entscheidende Schnittstelle zwischen Forschung und Patientenversorgung. Sie ermöglicht nicht nur die frühzeitige Erkennung und Überwachung von Krankheiten, sondern spielt auch eine zentrale Rolle bei der individualisierten Medizin, indem sie gezielte Therapien basierend auf der genetischen und molekularen Signatur eines Individuums ermöglicht.

Themenwelt Diagnostik
Die Diagnostik ist das Herzstück der modernen Medizin und bildet in der Biotech- und Pharmabranche eine entscheidende Schnittstelle zwischen Forschung und Patientenversorgung. Sie ermöglicht nicht nur die frühzeitige Erkennung und Überwachung von Krankheiten, sondern spielt auch eine zentrale Rolle bei der individualisierten Medizin, indem sie gezielte Therapien basierend auf der genetischen und molekularen Signatur eines Individuums ermöglicht.




















































