Krebszellen molekular ausschalten
Ein bislang unbekannter Ansatz
Anzeigen
LMU-Forscher haben ein Enzym identifiziert, das für Reparaturen im Erbgut erforderlich ist. Entfernt man dieses Enzym, gehen Zellen mit DNA-Schäden zugrunde: eine mögliche Strategie, um die Erkrankung zu behandeln.
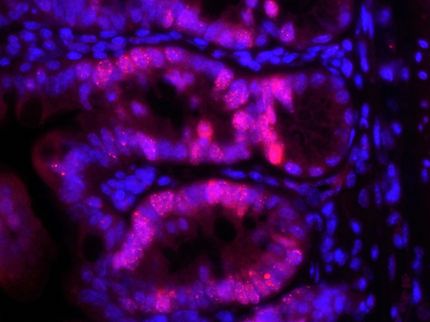
Mit der Anfärbung (rechts) zeigen sich Zellen ohne funktionierende DNA-Reparatur.
AG Ladurner
Krebserkrankungen zählen nach Herz-Kreislauf-Erkrankungen zu den häufigsten Todesursachen in Deutschland. Zwar handelt es sich bei Krebs um ganz unterschiedliche Erkrankungen. Es gibt aber einen kleinsten gemeinsamen Nenner: Im Gegensatz zu normalen Zellen vermehren sich Krebszellen unkontrolliert.
Mögliche Auslöser sind Schäden im Erbgut, der DNA. Das kann durch UV-Licht, Röntgen- oder Gammastrahlung, durch Chemikalien oder durch Sauerstoffradikale geschehen. Auch vererbte Mutationen führen mitunter zu Krebs. Doch unser Körper weiß sich in vielen Fällen selbst zu helfen. Je nach Größe des Schadens werden verschiedene Programme aktiviert. Reparaturenzyme beheben kleinere Defekte am Erbgut. Bei großen, irreversiblen Schäden kommt es zur Apoptose, dem induzierten Zelltod. Anschließend entfernen Makrophagen, also Fresszellen, die Überreste.
Mechanismen, um DNA-Schäden zu reparieren, sind für den menschlichen Körper lebensnotwendig. Geht es darum, Krebs mit Arzneimitteln zu behandeln, stören sie jedoch. Denn Ärzte wollen im Zuge einer Therapie Zellen eliminieren, deren Erbgut sich stark verändert. Schon lange suchen Forscher deshalb nach molekularen Achillesfersen in diesen Zellen mit defekten DNA-Reparaturwegen – und wurden fündig.
Krebszellen in den Tod treiben
Zu den möglichen Zielen von Arzneistoffen gehören sogenannte Poly(ADP-Ribose)-Polymerasen, kurz PARP. Es gibt 18 Vertreter. „PARP1 und PARP2 sind DNA-Reparaturenzyme, deren Wirkung seit mehr als 50 Jahren bekannt ist“, sagt Professor Andreas Ladurner, Inhaber des Lehrstuhls für Physiologische Chemie am Biomedizinischen Centrum München der LMU. Ladurner: „Seit 2005 werden PARP auch als Zielstrukturen in der Krebsforschung besonders intensiv untersucht.“
Zum Hintergrund: Bei manchen Frauen mit Brustkrebs oder Eierstockkrebs liegen Veränderungen in den Genen BRCA1 oder BRCA2 vor. BRCA ist normalerweise für die Reparatur bestimmter Brüche in der DNA zuständig. Funktionieren in Krebszellen diese Mechanismen nicht mehr, bleiben als letzter Ausweg nur noch PARP-Enzyme. Das ist die Achillesferse dieser Tumore. Hemmt man diese mit Arzneistoffen, gehen Zellen zugrunde.
Solche Medikamente sind zwar effektiv, haben aber Nebenwirkungen, weil sie mitunter auch weitere PARP-Enzyme inaktivieren. Geschwächte Patientinnen vertragen die Behandlungen nicht immer.
Eine neue Strategie zur Krebsbehandlung
Genau hier setzt das Team um Ladurner an, indem sich die Forscher auf die Suche nach alternativen Achillesfersen gemacht haben. Ihre zentralen Fragen: Welche Faktoren sind außer PARP erforderlich, damit DNA-Schäden repariert werden? Und eignen sie sich als Zielstruktur für Therapien?
„PARP1 oder PARP2 sind wie ein Notruf; sie erzeugen ein chemisches Signal, führen selbst aber noch keine Reparatur durch“, berichtet Ladurner. „Hier kommt ein weiteres Enzym, ALC1 genannt, ins Spiel.“ Um diese Vermutung zu prüfen, stellten die Forscher mit genetischen Methoden Zellen ohne funktionsfähiges ALC1 her. In dieser speziellen Situation konnten sich PARP-Enzyme nicht mehr vom Ort der DNA-Reparatur ablösen.
„Interessanterweise ist dieser Effekt mit der bekannten Hemmung von PARP durch Arzneistoffe vergleichbar“, so Ladurner. Man schaltet aber nicht PARP1 oder PARP2 selbst aus, wie das zugelassene Arzneistoffe machen. Vielmehr wird die molekulare Maschine ALC1 lahmgelegt: ein bislang unbekannter Ansatz. Ohne funktionsfähige Reparatur kommt es auch hier zum Tod von Krebszellen.
Dieses Wissen möchte Ladurner von der Grundlagenforschung in die Anwendung bringen, um neue Therapien zu entwickeln. Er ist Mitbegründer von Eisbach Bio, einem Startup mit Sitz in Planegg bei München. Um Zielstrukturen wie ALC1 in Tumoren auszuschalten, haben die Forscher bereits geeignete Moleküle identifiziert, die jetzt in die Anwendung am Menschen gebracht werden sollen.