Convencer a las células cancerosas para que se suiciden
Un equipo de LMU ha identificado una enzima que es esencial para la reparación del ADN. La pérdida de este factor lleva a la muerte celular cuando las células cancerosas acumulan daño en el ADN. La inhibición química de la proteína objetivo ofrece una posible estrategia para el tratamiento de cánceres específicos.
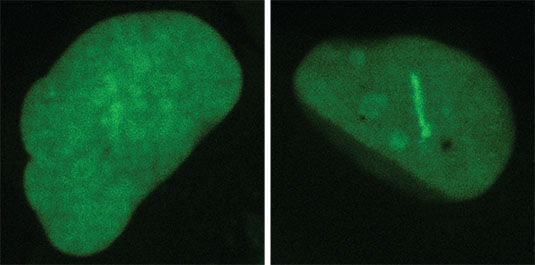
La tinción intensiva (derecha) muestra células con una maquinaria de reparación de ADN deficiente.
AG Ladurner
En Alemania, como en la mayoría de los países occidentales, el cáncer ocupa el segundo lugar, después de las enfermedades cardiovasculares, como la causa más frecuente de muerte. Aunque el término "cáncer" abarca una amplia gama de trastornos que varían significativamente en su curso y frecuencia, todos los síndromes de cáncer tienen una característica en común: a diferencia de las células normales, las células cancerosas proliferan de forma descontrolada.
La pérdida de la capacidad de regular el crecimiento y la división celular suele estar asociada a mutaciones perjudiciales en el ADN, el material hereditario, que determina la composición molecular, y por tanto las funciones, de todos los tipos de células del cuerpo. Entre los agentes que pueden causar esas mutaciones se encuentran la luz ultravioleta, los rayos X y los rayos gamma, así como sustancias químicas específicas, toxinas y formas de oxígeno altamente reactivas conocidas como radicales de oxígeno. Además, las mutaciones hereditarias ("innatas") también pueden promover el desarrollo de cánceres. Dado que los mutágenos son ubicuos y las mutaciones se producen con frecuencia durante la replicación del ADN, las células han desarrollado múltiples mecanismos que reparan el ADN dañado. Según el tamaño y la naturaleza de la lesión, las células activan diversas respuestas al daño del ADN. Las enzimas de reparación son capaces de corregir defectos de pequeña escala en el ADN celular, mientras que las lesiones acumulativas e irreversibles desencadenan la apoptosis, una forma de suicidio celular inducido.
Los mecanismos que median la reparación del ADN son vitales para la supervivencia. Sin embargo, como las células tumorales se dividen más rápidamente que muchos otros tipos de células, los agentes que promueven activamente el daño del ADN se utilizan a menudo como agentes terapéuticos. Este enfoque elimina selectivamente las células cancerosas que ya han sufrido un grado significativo de daño en el ADN. En este contexto particular, los sistemas funcionales de reparación del ADN son un obstáculo más que una ayuda. Esto explica por qué los investigadores han tratado durante mucho tiempo de identificar los puntos débiles de la red de vías de reparación que podrían servir como objetivos de medicamentos para el tratamiento de los cánceres, y la búsqueda no ha sido en vano.
Incitar a las células cancerosas a suicidarse
Uno de esos objetivos es una clase de enzimas conocidas como polimerasas poli(ADP-ribosa) (PARP, por sus siglas en inglés), de las cuales 18 han sido identificadas en humanos. "Las PARP1 y PARP2 son enzimas de reparación del ADN, cuyo modo de acción ha sido estudiado por el campo durante 50 años", dice el profesor Andreas Ladurner, que ocupa la cátedra de química fisiológica en el Centro Biomédico de LMU. "Especialmente desde 2005, los PARP han sido estudiados intensamente como potenciales blancos de drogas en el contexto del cáncer", añade.
Los inhibidores de PARP han sido particularmente útiles en el tratamiento de los cánceres de mama y ovario. En muchos casos, estos cánceres carecen de los genes funcionales BRCA1 o BRCA2. Las proteínas codificadas por estos genes están implicadas en la reparación de las roturas de una sola cadena en el ADN. La pérdida de estos genes inhabilita esta vía en particular, y obliga a las células tumorales a utilizar un mecanismo alternativo en el que las enzimas PARP son clave. Esta dependencia de las PARP las hace muy vulnerables a los medicamentos que inhiben estas enzimas.
Aunque los inhibidores de PARP son clínicamente eficaces, no están libres de efectos secundarios, en parte porque interfieren con las funciones de las enzimas PARP más allá de la reparación del ADN. Por lo tanto, no son adecuados para su uso en todos los pacientes.
Un nuevo objetivo para el tratamiento del cáncer
Ladurner y sus colegas esperan cambiar esto, y han comenzado a buscar puntos de ataque alternativos. En su último estudio, se propusieron responder a dos preguntas: Aparte de los PARP, ¿qué otros factores se requieren para la reparación de los daños en el ADN, y cuáles de ellos podrían proporcionar objetivos prometedores para las drogas terapéuticas?
"PARP1 y PARP2 actúan como una trompeta. Una vez que se unen al ADN dañado, envían una fuerte señal de daño al ADN que promueve las respuestas de reparación; no están directamente involucrados en la ejecución de la reparación del ADN", explica Ladurner. "Aquí es donde otra enzima, llamada ALC1, entra en juego, ya que responde específicamente a la señal enviada por los PARPs". Para identificar la función precisa de la ALC1, él y su equipo utilizaron métodos genéticos para crear células que carecían de la proteína funcional ALC1. Una mirada más cercana a las propiedades de estas células reveló que, en ausencia de ALC1, las enzimas PARP permanecen unidas al sitio del daño del ADN.
"Curiosamente, este efecto de 'atrapamiento' es comparable al causado por los inhibidores de las PARP 1 y 2", dice Ladurner. Pero mientras que los inhibidores de PARP actualmente en uso bloquean la generación de la señal producida por los PARP, la inactivación del ALC1 desactiva la propia maquinaria de reparación del ADN. Por lo tanto, este novedoso enfoque proporciona un medio más directo de inhibir la vía de reparación - y conduce a la muerte de las células tumorales sin interrumpir la función de otros PARPs. De hecho, la pérdida de la función de la ALC1 potencia la acción de los inhibidores de PARP 1 y 2.
Ladurner espera traducir los hallazgos de laboratorio como este en nuevas terapias. Es cofundador de Eisbach Bio, una start-up ubicada en Planegg, cerca de Munich. Él y sus colegas ya han identificado fármacos candidatos para la inhibición de objetivos como el ALC1 en tumores, que esperan probar en humanos en un futuro próximo.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.