Toxoplasmose-Erreger: Organspende für Tochterzellen
Recyclingmechanismus stellt Vermehrung des Parasits Toxoplasma gondii sicher
Anzeigen
Toxoplasma gondii, der Erreger der Toxoplasmose, vermehrt sich auf eine ungewöhnliche Weise, die als interne Knospung bezeichnet wird. Dabei bilden sich im Inneren der Mutterzelle, die sich während dieses Vorgangs letztlich auflöst, zwei Tochterzellen. Dieser Vorgang setzt sich so lange fort, bis die Wirtszelle aufplatzt. Der weltweit verbreitete Parasit löst beim Menschen eine in der Regel harmlose Infektion aus, kann aber während einer Schwangerschaft dem ungeborenen Kind schaden. Ein Team um Markus Meissner, Professor für Experimentelle Parasitologie an der LMU, hat gemeinsam mit Dr. Javier Periz und weiteren Kollegen der Universität Glasgow, Schottland, einen Mechanismus aufgedeckt, der bei dieser Art der Vermehrung offenbar eine wichtige Rolle spielt und durch den bestimmte Organellen der Mutterzelle für die Tochterzellen recycelt werden.
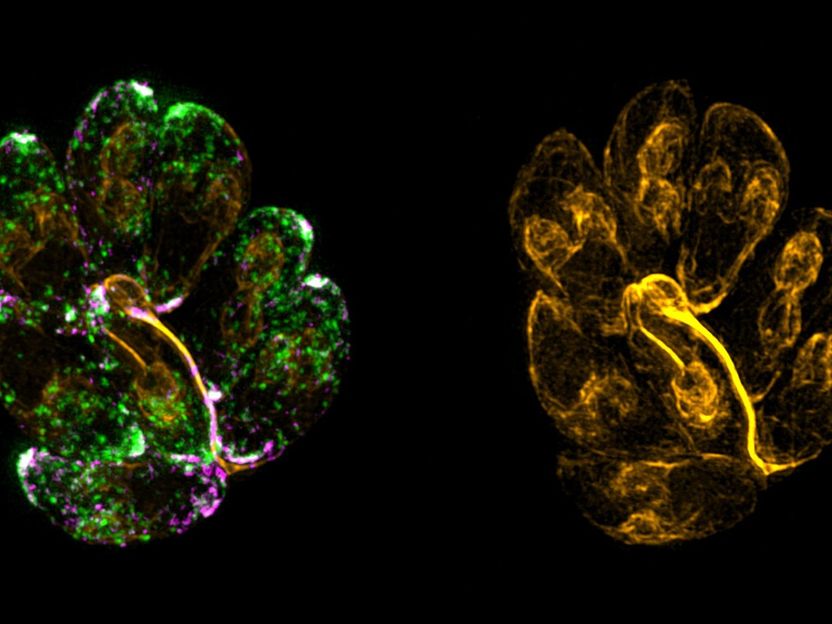
F-Aktin-Netzwerk (gelb), das für das Recycling von Mikronemen (grün) benötigt wird. Das Bild zeigt eine intrazelluläre parasitophore Vakuole im 8-Zell-Stadium, die über den "Residualkörper" verbunden ist, der von der F-Aktin-Dynamik organisiert wird.
Dr. Javier Periz, University of Glasgow
Um Wirtszellen erkennen und infizieren zu können, besitzt T. gondii Organellen, sogenannte Rhoptrien und Mikroneme, die dafür spezifische Proteine ausscheiden. Nach einer erfolgreichen Infektion teilt sich der Parasit und bisher wurde angenommen, dass diese Organellen in den Tochterzellen neu gebildet werden. Indem sie ein Mikronem-Protein markierten und sein Schicksal während des Zellzyklus mithilfe hochauflösender Mikroskopie verfolgten, konnten die Wissenschaftler nun jedoch nachweisen, dass die Mikroneme der Mutterzelle recycelt und auf die sich bildenden Tochterzellen aufgeteilt werden. Dabei erhält jede Tochterzelle etwa die Hälfte des Materials der Mutterzelle, gleichzeitig werden auch Mikroneme in der Tochterzelle neu synthetisiert. Die Wissenschaftler nehmen an, dass sich dieses Recycling nicht auf die Mikroneme beschränkt, sondern ein allgemeiner Mechanismus ist.
„Zudem haben wir entdeckt, dass die recycelten Mikroneme über die Aktin-Filamente des Zellskeletts von der Mutter- zu den Tochterzellen transportiert werden“, sagt Markus Meissner. „Damit haben wir eine völlig neue Funktion des Aktins im Parasiten gefunden, von dem man bisher dachte, dass es nur an der Beweglichkeit des Parasiten direkt beteiligt ist. Wenn wir verstehen, wie dieses Aktin reguliert wird, könnten sich interessante neue Angriffsziele für potenzielle Medikamente ergeben. Das ist umso interessanter, weil T. gondii nur sehr wenige Aktin-regulierende Proteine besitzt.“























































