La recherche sous haute pression
Pourquoi 3 000 barres sont nécessaires pour étudier une protéine de manière exhaustive ?
Frederic Berner et Michael Kovermann, chercheurs à l'université de Constance, présentent une nouvelle méthode de spectroscopie à haute pression qui permet d'élucider les propriétés des structures natives des protéines.
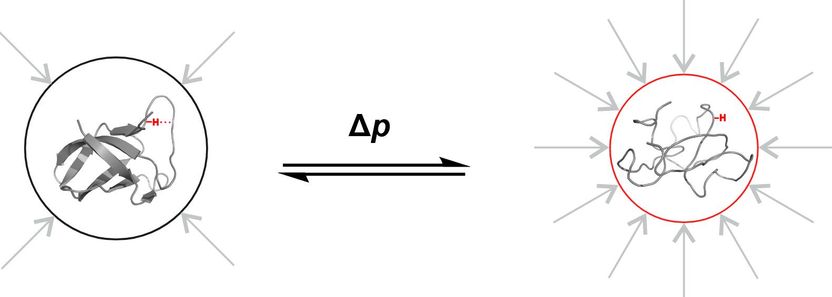
Image schématique du pliage de la protéine de choc froid B de Bacillus subtilis en fonction de la pression hydrostatique. La chaîne d'acides aminés se plie comme un ruban de papier.
Copyright: AG Kovermann, Universität Konstanz
Dans le laboratoire de spectroscopie RMN de l'université de Constance, la protéine de choc froid B de Bacillus subtilis est soumise à une pression de 3 000 bars dans un petit tube. C'est environ trois fois la pression de l'eau au point le plus profond de l'océan. La pression est si intense que la protéine hautement dynamique présente des caractéristiques structurelles qui ne seraient pas suffisamment visibles sous une pression normale. Mais pourquoi les scientifiques appliquent-ils une pression aussi élevée, qui ne se produit nulle part ailleurs sur notre planète dans des conditions naturelles ? La réponse est simple : Pour étudier des processus et des propriétés qui sont trop volatiles pour être observés dans des conditions normales.
"Cette pression élevée nous permet de rendre visibles des états qui existent réellement à 1 bar, mais que nous ne pouvons observer directement qu'à 3 000 bars", explique Frederic Berner, de l'université de Constance. Littéralement "sous haute pression", le chercheur doctorant étudie les propriétés d'une protéine déterminées par sa structure et la manière dont les modifications de la structure influencent à leur tour ses propriétés. Au sein du groupe de recherche Chimie physique et résonance magnétique nucléaire de l'université de Constance, dirigé par Michael Kovermann, il a récemment mis en œuvre une nouvelle méthode permettant d'analyser les propriétés structurelles des protéines à 3 000 bars, avec le moins d'influence possible des effets environnants. Les deux chercheurs présentent aujourd'hui leur nouvelle approche méthodologique dans la revue Angewandte Chemie International Edition.
Protéines : comment la structure influence leurs propriétés
Les protéines sont les éléments de base de la vie. Elles sont constituées de chaînes d'acides aminés dont la structure tridimensionnelle peut prendre des formes très variées. Elles se "plient" de la même manière qu'un long ruban de papier peut être plié en différentes formes. Les propriétés fonctionnelles d'une protéine dépendent en grande partie de son pliage, de sorte qu'une même protéine peut avoir des effets très différents dans la cellule, en fonction de la forme dans laquelle elle est pliée. "Ce qui est important pour les protéines, c'est leur structure, qui est à son tour liée aux fonctionnalités. Si vous voulez identifier des mécanismes biochimiques, vous avez besoin d'informations sur leur structure", explique Berner.
Les scientifiques cherchent à saisir les propriétés de la structure de la protéine sous sa forme "pure", c'est-à-dire aussi peu influencée que possible par son environnement. Premièrement, il existe presque toujours des interactions avec le solvant qui entoure la protéine et avec les sections voisines de sa chaîne moléculaire. D'autre part, les protéines sont très dynamiques, leur pliage est toujours en mouvement. Par exemple, il existe des protéines qui se plient et se replient constamment comme des ciseaux. Dans la fraction de seconde où ils s'ouvrent, une réaction chimique a lieu. Ce phénomène est beaucoup trop rapide pour que les chercheurs puissent l'examiner directement.
Sous haute pression
C'est là qu'intervient la pression de 3 000 bars : La molécule est pressée dans un certain état - sa structure est manipulée : Les ciseaux restent ouverts. Grâce à la spectroscopie par résonance magnétique, les chercheurs peuvent désormais étudier des propriétés structurelles spécifiques de la protéine qui ne sont pas directement visibles sous une pression normale.
Les méthodes d'analyse précédentes acceptaient souvent les effets environnementaux et tentaient de les prendre en compte par la suite. La nouvelle méthode à haute pression de Kovermann et Berner, en revanche, peut supprimer ou "corriger" les effets de l'environnement dès le départ ("intrinsèquement") et permet ainsi de visualiser la protéine avec le moins d'effets possible. Il est particulièrement judicieux d'utiliser et de comparer la nouvelle méthode en combinaison avec les méthodes existantes, car les différents facteurs d'influence deviennent ainsi visibles en détail. Le procédé à haute pression inventé par l'université de Constance a donné de très bons résultats dès la première phase de son application. Frederic Berner et Michael Kovermann expliquent que d'autres expériences et simulations informatiques vont maintenant avoir lieu pour tester et éventuellement affiner le processus.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.






































