Leipziger Forscher schauen der Evolution über die Schulter
Enzyme die für die Reifung und Funktionalität von tRNAs von Bedeutung sind
Anzeigen
Leipziger Forscher haben ein Beispiel dafür gefunden, wie die Evolution auf Molekülebene funktioniert. Die Wissenschaftler rund um Prof. Dr. Mario Mörl vom Institut für Biochemie der Universität Leipzig haben sich mit Enzymen beschäftigt, die für die Reifung und Funktionalität so genannter tRNAs von Bedeutung sind.
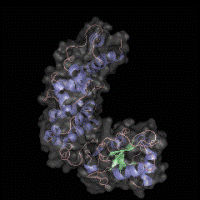
Darstellung CCA-Enzym
Prof. Dr. Mario Mörl / Universität Leipzig
"tRNAs sind deshalb so wichtig, weil sie als Adaptormoleküle mit Aminosäuren beladen werden und dafür sorgen, dass der in der DNA angelegte 'Bauplan' für Organismen umgesetzt werden kann", erläutert Prof. Mörl zu den Untersuchungen seines Teams, deren Ergebnisse die Forscher kürzlich im Fachmagazin "Proceedings Of The National Academy Of Science of the United States of America" ausführlich darstellen konnten. Ihr Hauptaugenmerk galt dabei den CCA-Enzymen.
tRNAs sorgen für die Übersetzung der im Erbgut eingelagerten Informationen zum Aufbau von Proteinen, wie beispielsweise Insulin. Damit eine tRNA mit einem Proteinbaustein beladen werden kann, benötigt sie eine entsprechende Beladungsstelle. Diese besteht aus drei aufeinander folgenden Nukleotiden, zwei C- und einem A-Nukleotid (CCA). Normalerweise, so Prof. Mörl, synthetisieren spezialisierte Katalysatoren, die CCA-Enzyme, diese Andockstelle. "Es gibt aber auch Organismen, die ein Zwillingspaar an Enzymen besitzen, die sich diese Aufgabe teilen: ein Enzym addiert die beiden C-Reste, ein zweites das am Ende stehende A."
Nun war bislang völlig unbekannt, weshalb ein CC-Enzym kein A-Nukleotid einbauen kann. Hier haben die Leipziger Forscher jetzt eine Wissenslücke schließen können. "Man kann sich das fast wie bei einer Maschine vorstellen, bei der bestimmte Bauteile, etwa Zahnräder, an genau festgelegten Stellen vorhanden sein müssen, damit die Maschine als Ganzes funktioniert", erklärt der Biochemiker. Dabei kommt es darauf an, dass jedes Maschinenteil an der richtigen Stelle sitzt, die richtige Form und Größe hat. Bei den Enzymen ging es deshalb um die Frage, was den Einbau von A bei den CC-Enzymen verhindert.
"Wir konnten zeigen, dass in dem Enzym ein wichtiges Gelenk fehlt, das zum Einbau des A-Nukleotids benötigt wird", so Mörl. Vergleichbar sei dies mit einer Zange: Je nachdem, wie weit sie sich öffnet, können unterschiedlich starke Materialien damit gegriffen werden. Beim Aufbau des CC-Enzyms ist es ähnlich: Fehlt das beschriebene Gelenk, kann es nur zum Einbau des kleineren C-Nukleotids kommen, weil das nicht weiter geöffnete Enzym das größere A -Nukleotid nicht binden kann.
Die Leipziger Wissenschaftler gingen bei ihren Forschungen aber noch einen entscheidenden Schritt weiter. Nachdem sie das Fehlen der Gelenk-Region beim CC-Enzym definitiv festgestellt hatten, machten sie sich daran, den Mangel zu beheben: "Wir bauten das Gelenk aus einem CCA-Enzym aus und transplantierten es in ein CC-Enzym", so Mörl. Die daraus entstehende Chimäre war dann wieder in der Lage, ein A einzubauen, so dass die komplette CCA-Sequenz wieder aufgebaut werden konnte.
Das Team um Prof. Mörl hat also der Evolution über die Schulter schauen und nachvollziehen können, wie die Natur in einer Art molekularem Baukasten Enzyme mit veränderten Funktionen zusammensetzt. "Das funktioniert aber nur, wenn vorher wie bei einem Computer eine Sicherungskopie wichtiger Dateien als Backup angelegt wurde", unterstreicht Mörl: Bevor die Natur 'Experimente' mit den Enzymen ausprobiert, muss ein Duplikat des Enzymbauplans im Erbgut abgelegt worden sein. Dadurch ist sichergestellt, dass - wie im untersuchten Fall - eine Zelle nicht stirbt, wenn eines der CCA-Enzyme in ein CC-Enzym umgewandelt wird.
























































