Oxidantien an den Schalthebeln der Zelle
Anzeigen
Wie körpereigene Oxidantien das normale und krankhafte Verhalten von Zellen über schwefelhaltige Schaltermoleküle steuern, erforschen Wissenschaftler in einem neuen Schwerpunktprogramm der Deutschen Forschungsgemeinschaft DFG. Die Programmkoordinatoren sind Prof. Katja Becker, Universität Gießen, und PD Dr. Tobias Dick vom Deutschen Krebsforschungszentrum.
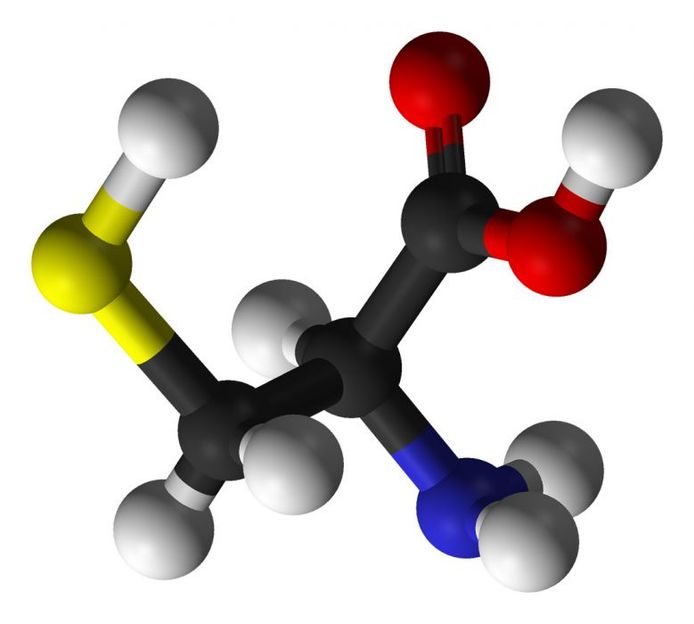
Modell der Aminosäure Cystein, die eine Thiolgruppe enthält (das Schwefelatom ist gelb dargestellt)
Benjah-bmm27, Wikimedia Commons
Reaktive Sauerstoffverbindungen, oft auch als freie Radikale bezeichnet, sind besser als ihr Ruf: Neue Forschungsergebnisse zeigen, dass Oxidantien im Organismus positive und zentrale Funktionen ausüben und das Wachstum und die Differenzierung von Zellen steuern. Um als körpereigener Signalgeber zu dienen, müssen Oxidantien die Funktion von Proteinen in der Zelle spezifisch verändern. Dies geschieht durch sogenannte Thiol-Schalter, die im neuen Schwerpunktprogramm näher erforscht werden sollen.
Ein Thiol ist eine molekulare Gruppe, die aus Schwefel und Wasserstoff besteht. Die Aminosäure Cystein, Bestandteil aller Proteine unseres Körpers, trägt eine solche Thiolgruppe. Sie kann durch Oxidation spezifisch und reversibel modifiziert werden – was dann auch die Funktion des jeweiligen Proteins verändert.
Dieses wichtige biologische Regulationssystem ist noch großenteils unerforscht. Wenn alle Proteine Thiole enthalten, wie kommt es dann, dass unter den normalen zellulären Bedingungen nur einige darunter oxidiert werden und als Schalter funktionieren? Diese Frage der Spezifität wollen die Wissenschaftler im neuen Schwerpunktprogramm untersuchen und die Rolle der Thiole in gesunden und kranken Zellen sowie ihre Bedeutung bei Entzündungen, Infektionskrankheiten und Krebs verstehen.
Meistgelesene News
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.