Ultraschnelles Tempo im Gehirn: Neue Erkenntnisse zu Kalziumtransport und Signalverarbeitung
Anzeigen
Forschende der Universität Freiburg haben gemeinsam mit Partnern den Mechanismus ultraschneller Kalziumpumpen in Nervenzellen entschlüsselt. Diese sogenannten PMCA2-Neuroplastin-Komplexe arbeiten mit mehr als 5.000 Zyklen pro Sekunde und beenden Kalziumsignale im Millisekundenbereich – und damit 100-mal schneller als bisher bekannt. Damit tragen sie entscheidend zur schnellen Informationsverarbeitung im Gehirn bei. Die Ergebnisse eröffnen neue Perspektiven für das Verständnis neuronaler Erkrankungen und mögliche therapeutische Ansätze – zum Beispiel gegen erblich bedingte Taubheit.
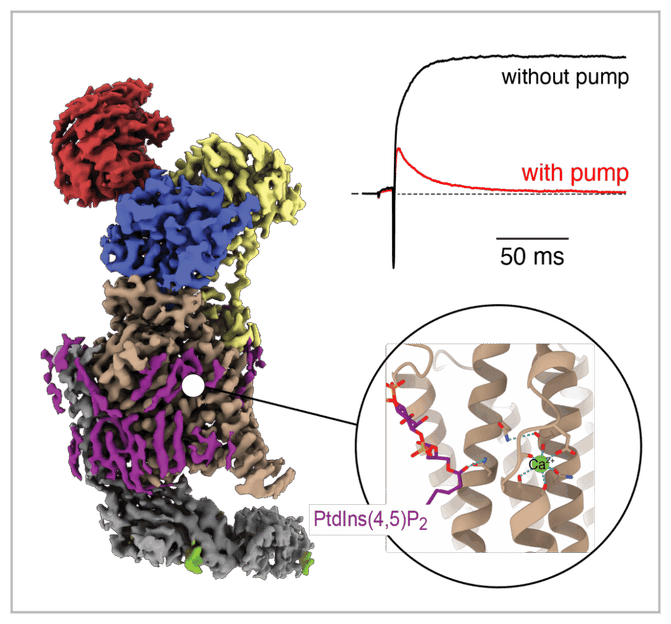
So schnell arbeitet das Gehirn: Diese 3D-Aufnahme zeigt eine Kalziumpumpe, die Kalzium-Ionen mit Raten von mehr 5.000 pro Sekunde transportiert. Unten rechts ist die Bindungsstelle für das Membranlipid vergrößert zu sehen, oben rechts die Auswirkung der Pumpenaktivität auf ein Kalzium-vermitteltes Signal.
Prof. Dr. Bernd Fakler
Ob wir denken, hören oder uns bewegen – all diese Prozesse beruhen auf elektrischen Signalen in unseren Nervenzellen. Ausgelöst werden sie durch das Zusammenspiel von Ionen wie Kalzium. Doch so wichtig Kalzium für die Signalübertragung ist: Zu viel davon darf nicht in der Zelle bleiben. Ein unausgeglichener Kalziumspiegel kann die Zellfunktion stören und langfristig Krankheiten begünstigen – darunter erblich bedingte Taubheit. Deshalb ist es entscheidend, dass die Zellen Kalzium nach jedem Signal schnell und präzise wieder abpumpen.
Diese Aufgabe übernehmen Komplexe aus einer Plasmamembran-Kalzium-Adenosintriphosphatase (ATPase)-Untereinheit und einem Neuroplastin-Protein, sogenannte Kalziumpumpen. Dass diese mit einer mehr als 100-mal höheren Transportgeschwindigkeit als bislang angenommen arbeiten, zeigt eine experimentelle zellphysiologische Studie unter Leitung von Prof. Dr. Bernd Fakler, Direktor des Instituts für Physiologie der Universität Freiburg und Mitglied des Exzellenzclusters CIBSS – Centre for Integrative Biological Signalling Studies sowie von BIOSS – Centre for Biological Signalling Studies: Indem sie Kalziumionen mit einer Transportgeschwindigkeit von mehr als 5.000 Zyklen pro Sekunde aus den Zellen schleusen, können aktive, Adenosintriphosphat (ATP)-verbrauchende Kalziumpumpen der Zellmembran die Kalziumkonzentration im Zellinneren innerhalb weniger Millisekunden von 10 mikromolar auf unter 0,1 mikromolar senken.
„Unsere zwei Studien zeigen: Die Pumpenkomplexe in der Zellmembran entfernen Kalziumionen in Nervenzellen mit Transportraten von mehr als 5.000 Zyklen pro Sekunde – und damit mehr als 100-mal schneller als bisher bekannt. Zudem haben wir den entscheidenden Funktionsmechanismus für die hohen Pumpgeschwindigkeiten identifiziert, und damit eine fundamentale Voraussetzung für die Informationsverarbeitung im Millisekundenbereich geklärt. Kombiniert erweitern die Studienergebnisse das Wissen um Signalverarbeitung im Gehirn und eröffnen neue Ansätze für Medikamente – zum Beispiel gegen erblich bedingte Taubheit“, sagt Prof. Dr. Bernd Fakler.
Zum Vergleich: Kalzium-ATPase-Typen in intrazellulären Membranen arbeiten mit Umsatzraten von wenigen zehn Zyklen pro Sekunde. Für seine funktionellen Experimente nutzte das Team Kalzium-aktivierte Kaliumkanäle als ultraschnelle Sensoren, die Änderungen der Kalziumkonzentration im Bereich von Millisekunden sichtbar machen. Zusammen mit den per Elektronenmikroskopie ermittelten Dichten der Pumpenkomplexe in den Zellmembranen (rund 55 Komplexe pro Quadratmikrometer) konnten die Forschenden die Transportgeschwindigkeit der Pumpen berechnen; Letzteres erfolgte in Zusammenarbeit mit der Arbeitsgruppe von Prof. Dr. Heiko Rieger an der Universität des Saarlandes. Die Studienergebnisse sind am 20. August 2025 im Fachmagazin Nature Communications erschienen.
Membranlipid als Schlüsselfaktor für schnellen Transport
Wie sind diese hohen Transportgeschwindigkeiten möglich? Das Funktionsprinzip konnten die Freiburger Physiolog*innen, insbesondere Dr. Uwe Schulte, Mitarbeiter des Instituts für Physiologie, in Zusammenarbeit mit dem Max-Planck-Institut für Molekulare Physiologie unter der Leitung von Prof. Dr. Stefan Raunser klären; diese Studie wird parallel im Fachmagazin Nature veröffentlicht. Hierzu führten die Wissenschaftler*innen kryo-elektronenmikroskopische Analysen mit hoher räumlicher Auflösung (2,8–3,6 Å) von Plasmamembran-Kalzium-ATPase-2-(PMCA2)-Neuroplastin Pumpen in acht funktionellen Zuständen des Transportzyklus durch. Diese zeigen: Die Kalziumpumpen wirken mit dem Membranlipid PtdIns(4,5)P2 zusammen. Dessen Bindung erlaubt Schlüsselschritte im Transportzyklus, etwa die schnelle Bindung und Abgabe der Kalziumionen und ermöglicht so die außergewöhnlich hohe Pumpleistung. Ohne diese Lipidbindung verlangsamt sich der Transport massiv, was die Forschenden durch die Analyse von krankheitsverursachenden Mutationen der Pumpenstruktur belegen konnten. Überraschenderweise fanden sie auch heraus, dass die schnelle Pumpaktivität der PMCA2-Neuroplastin-Komplexe durch Thapsigargin, einen bekannten Hemmstoff der intrazellulären Kalziumpumpen, stark eingeschränkt wird – und zwar durch Blockierung der Bindungsstelle des PtdIns(4,5)P2.
Bedeutung für Gehirn und Medizin
Die Einblicke in die 3-D-Struktur der Pumpenkomplexe und das Verständnis der Lipid-abhängigen Regulation des Transports könnten neue Angriffspunkte für Wirkstoffe schaffen, die gezielt in Kalzium-regulierte Signalwege eingreifen.
Originalveröffentlichung
Cristina E. Constantin, Barbara Schmidt, Yvonne Schwarz, Harumi Harada, Astrid Kollewe, Catrin S. Müller, Sebastian Henrich, Botond Gaal, Akos Kulik, Dieter Bruns, Uwe Schulte, Heiko Rieger, Bernd Fakler; "Ca2+-pumping by PMCA-neuroplastin complexes operates in the kiloHertz-range"; Nature Communications, Volume 16, 2025-8-20
Deivanayagabarathy Vinayagam, Oleg Sitsel, Uwe Schulte, Cristina E. Constantin, Wout Oosterheert, Daniel Prumbaum, Gerd Zolles, Bernd Fakler, Stefan Raunser; "Molecular mechanism of ultrafast transport by plasma membrane Ca2+-ATPases"; Nature, 2025-8-20













































