Le rythme ultrarapide dans le cerveau : nouvelles connaissances sur le transport du calcium et le traitement des signaux
Des chercheurs de l'université de Fribourg, en collaboration avec des partenaires, ont découvert le mécanisme de transport ultrarapide des pompes à calcium dans les cellules nerveuses. Ces pompes, des complexes de protéines PMCA2 et neuroplastine, fonctionnent à plus de 5 000 cycles par seconde et terminent les signaux calciques en quelques millisecondes, soit 100 fois plus vite que ce que l'on connaissait jusqu'à présent. Elles jouent un rôle crucial dans le traitement rapide de l'information dans le cerveau. Ces découvertes ouvrent de nouvelles perspectives pour la compréhension des maladies neurologiques et des approches thérapeutiques possibles, notamment en ce qui concerne la surdité héréditaire.
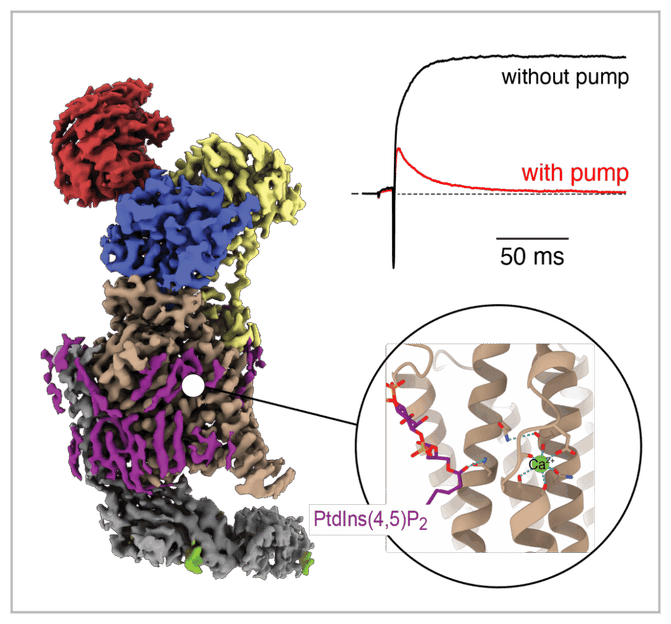
Pour un fonctionnement rapide du cerveau : L'image montre la structure 3D d'une pompe à calcium qui fonctionne à des taux de plus de 5 000 par seconde. Le site de liaison des lipides est agrandi en bas à droite, la terminaison rapide d'un signal calcique par l'activité de la pompe est représentée en haut à droite.
Prof. Dr. Bernd Fakler
Que nous pensions, entendions ou bougions, tous ces processus sont basés sur des signaux électriques dans nos cellules nerveuses. Ils sont déclenchés par l'interaction extrêmement précise d'ions tels que le calcium. Mais si le calcium est important pour la transmission des signaux, sa quantité doit être maintenue à un niveau minimal à l'intérieur des cellules. Un taux de calcium déséquilibré peut perturber les fonctions cellulaires et, à long terme, favoriser l'apparition de maladies, dont la surdité héréditaire. Par conséquent, l'élimination rapide du calcium par des pompes est cruciale et doit avoir lieu après chaque signal. Cette tâche est assurée par des complexes assemblés à partir d'une sous-unité de l'adénosine triphosphatase (ATPase) de la membrane plasmique et d'une protéine neuroplastine - les "pompes à calcium" de la membrane plasmique.
Bernd Fakler, directeur de l'Institut de physiologie de l'université de Fribourg et membre des pôles d'excellence CIBSS (Centre for Integrative Biological Signalling Studies) et BIOSS (Centre for Biological Signalling Studies), montrent que ces pompes fonctionnent à des taux de transport plus de 100 fois supérieurs à ce que l'on supposait jusqu'à présent. En pompant les ions calcium hors des cellules à plus de 5 000 cycles par seconde, les pompes à calcium actives de la membrane cellulaire, qui consomment de l'ATP, peuvent abaisser les concentrations intracellulaires de calcium de 10 micromolaires à moins de 0,1 micromolaire en l'espace de quelques millisecondes seulement.
"Nos deux études montrent que les complexes de pompes de la membrane cellulaire éliminent les ions calcium des cellules nerveuses à des taux de transport de plus de 5 000 cycles par seconde, soit 100 fois plus vite que ce que l'on connaissait jusqu'à présent. Nous avons également identifié le mécanisme clé de ce pompage rapide qui est fondamental pour le traitement de l'information à la milliseconde dans notre cerveau. Ensemble, ces résultats élargissent les connaissances sur le traitement des signaux dans le cerveau et ouvrent de nouvelles voies pour le développement de médicaments, par exemple contre la surdité héréditaire", déclare le professeur Bernd Fakler.
À titre de comparaison, les ATPases calciques des membranes intracellulaires fonctionnent à des taux de renouvellement de quelques dizaines de cycles par seconde seulement. Pour ses expériences fonctionnelles, l'équipe a utilisé des canaux potassiques activés par le calcium comme capteurs ultrarapides, visualisant les changements de concentration de calcium dans la plage de la milliseconde. En plus de la détermination des densités de complexes de pompes dans les membranes cellulaires par microscopie électronique (environ 55 complexes par micromètre carré), les chercheurs ont pu calculer la vitesse de transport des pompes. Ce calcul a été effectué en collaboration avec le groupe du professeur Heiko Rieger de l'université de la Sarre. Les résultats ont été publiés le 20 août 2025 dans Nature Communications.
Le lipide membranaire, facteur clé du transport rapide
Comment des taux de transport aussi élevés sont-ils possibles ? Le principe moléculaire qui sous-tend cette opération ultrarapide a été élucidé par des physiologistes de Fribourg, en particulier le Dr Uwe Schulte de l'Institut de physiologie, en collaboration avec l'Institut Max Planck de physiologie moléculaire, sous la direction du Prof. Cette étude sera publiée dans la revue Nature. Les scientifiques ont effectué des analyses par cryo-microscopie électronique à haute résolution spatiale (2,8-3,6 Å) des pompes PMCA2-neuroplastine dans huit états fonctionnels du cycle de transport. Ces études montrent que les pompes à calcium interagissent avec le lipide membranaire PtdIns(4,5)P2. Sa liaison favorise les étapes clés du cycle de transport, telles que la fixation et la libération rapides des ions calcium, permettant ainsi un pompage exceptionnellement rapide. Sans cette interaction lipidique, le transport ralentit considérablement, comme le montrent les altérations de la structure de la pompe dues à des mutations pathologiques. De manière surprenante, les chercheurs ont également découvert que l'activité de pompage rapide des complexes PMCA2-neuroplastine est fortement inhibée par la thapsigargin, un inhibiteur bien connu des pompes à calcium intracellulaires, sur la base de sa perturbation de la liaison des PtdIns(4,5)P2 à son site dans la sous-unité PMCA.
Importance pour le cerveau et la médecine
L'étude de la structure 3D des complexes de pompes et la compréhension de la régulation de l'activité de transport en fonction des lipides pourraient fournir de nouvelles cibles médicamenteuses pour le contrôle spécifique des voies de signalisation du calcium.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Cristina E. Constantin, Barbara Schmidt, Yvonne Schwarz, Harumi Harada, Astrid Kollewe, Catrin S. Müller, Sebastian Henrich, Botond Gaal, Akos Kulik, Dieter Bruns, Uwe Schulte, Heiko Rieger, Bernd Fakler; "Ca2+-pumping by PMCA-neuroplastin complexes operates in the kiloHertz-range"; Nature Communications, Volume 16, 2025-8-20
Deivanayagabarathy Vinayagam, Oleg Sitsel, Uwe Schulte, Cristina E. Constantin, Wout Oosterheert, Daniel Prumbaum, Gerd Zolles, Bernd Fakler, Stefan Raunser; "Molecular mechanism of ultrafast transport by plasma membrane Ca2+-ATPases"; Nature, 2025-8-20





































