Der Geschmackssinn: Wie SNAP25 Geschmackssignale erzeugt und Sinneszellen am Leben erhält
SNAP25 ermöglicht die Wahrnehmung des sauren Geschmacks, indem es sowohl die Signalübertragung als auch das langfristige Überleben der Geschmackszellen vom Typ III unterstützt
Die Zunge enthält zahlreiche Geschmacksknospen - winzige Sinnesorgane, die für die Wahrnehmung von Geschmack zuständig sind. Die Geschmacksknospen bestehen aus spezialisierten Zellen, die chemische Reize in neuronale Signale umwandeln. Typ-II-Zellen, die auf süße, umami und bittere Reize reagieren, nutzen eine kanalbasierte Signalübertragung. Im Gegensatz dazu wird angenommen, dass Typ-III-Zellen saure Signale über synaptische Vesikelfreisetzung vermitteln. Während die Signalmechanismen von Typ-II-Zellen gut charakterisiert sind, ist der Prozess der vesikulären synaptischen Übertragung in Typ-III-Zellen nur unzureichend bekannt.
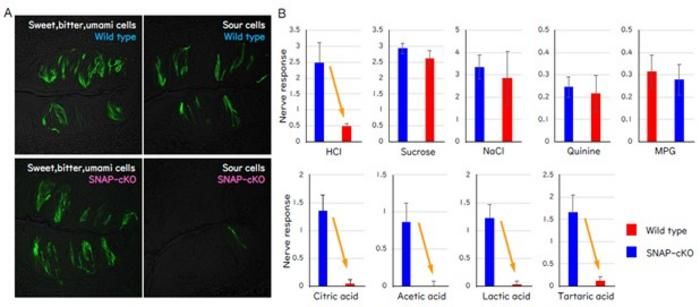
A) Geschmacksgewebe von Wildtyp-Mäusen und Mäusen mit synaptischer Dysfunktion der Geschmackszellen (SNAP-cKO). Bei SNAP-cKO-Mäusen ist die Anzahl der sauer reagierenden Zellen reduziert. B) Reaktionen des Geschmacksnervs auf verschiedene Geschmacksreize bei Wildtyp-Mäusen (rot) und SNAP-cKO-Mäusen (blau). Im Vergleich zu Wildtyp-Mäusen zeigten SNAP-cKO-Mäuse verminderte Reaktionen auf saure Reize (HCl, Zitronensäure, Essigsäure, Milchsäure und Weinsäure), während die Reaktionen auf süße, salzige, bittere und Umami-Reize nicht beeinträchtigt waren.
Professor Ryusuke Yoshida of Okayama University, Japan
Die synaptische Signalübertragung beruht auf dem SNARE-Komplex, einer Gruppe von Proteinen, die die Vesikelfusion vermitteln. Das Synaptosom-assoziierte Protein 25 (SNAP25), eine Schlüsselkomponente dieses Komplexes, ist für die synaptische Vesikelfusion in Neuronen unerlässlich. In der Zunge ist SNAP25 ausschließlich in Typ-III-Zellen zu finden. Welche Rolle spielt SNAP25 bei der Übertragung des sauren Geschmacks? Wie trägt es zur synaptischen Vesikelfreisetzung in Typ-III-Zellen bei?
Ein Forscherteam unter der Leitung von Professor Ryusuke Yoshida und Assistenzprofessor Kengo Horie von der Abteilung für orale Physiologie an der Universität Okayama, Japan, hat diese Fragen in einer neuen Studie untersucht, die im Journal of Physiology veröffentlicht wurde.
Das Team entwickelte ein Mausmodell, bei dem das Snap25-Gen selektiv aus epithelialen Geschmackszellen entfernt wurde. Diese konditionalen Knockout-Mäuse (cKO) überlebten bis ins Erwachsenenalter, allerdings mit einem signifikanten Verlust an Typ-III-Zellen sowohl in der fungiformen als auch in der circumvallaten Papille - zwei wichtigen Geschmacksknospenregionen auf der Zunge. Typ-II-Zellen blieben dagegen unbeeinflusst. Um herauszufinden, ob dieser Rückgang auf eine gestörte Zellbildung oder eine Degeneration zurückzuführen ist, markierten die Forscher neu gebildete Typ-III-Zellen mit EdU-Tracing. Sie stellten fest, dass Typ-III-Zellen zwar normal gebildet wurden, ihre Zahl jedoch innerhalb von 14 Tagen stark abnahm, was eher auf einen Defekt bei der langfristigen Zellerhaltung als auf eine Wiederauffüllung hinweist.
Elektrophysiologische Ableitungen des Nervus chorda tympani ergaben, dass Mäuse mit Snap25-Mangel stark verminderte Reaktionen auf sauer schmeckende Substanzen wie Salzsäure und Zitronensäure zeigten. Die Reaktionen auf süße, salzige, bittere und umami Geschmacksstoffe waren nicht beeinträchtigt, was darauf hindeutet, dass das beobachtete Defizit spezifisch für den sauren Geschmack ist.
"Unsere Ergebnisse zeigen, dass SNAP25 eine Doppelfunktion im Geschmackssystem hat", sagt Prof. Yoshida. "SNAP25 trägt nicht nur dazu bei, dass diese Zellen saure Geschmackssignale an das Gehirn senden, sondern ist auch für das Überleben der Typ-III-Zellen selbst entscheidend. Ohne SNAP25 verschwinden die Zellen schließlich, und ohne sie geht auch die Fähigkeit, den sauren Geschmack richtig zu erkennen, verloren."
Um zu untersuchen, wie SNAP25 das Verhalten beeinflusst, verwendeten die Forscher einen Kurzzeit-Lecktest. Normale Mäuse mieden saure Lösungen, aber Snap25 cKO-Mäuse zeigten weniger Abneigung. Dennoch blieb eine gewisse Abneigung bestehen, was darauf hindeutet, dass andere Signalwege beteiligt sein könnten. Um dies zu untersuchen, erzeugte das Team doppelte KO-Mäuse, denen beide Allele des Snap25-Gens in Typ-III-Zellen fehlten, und Transient-Receptor-Potential-Vanilloid 1 (Trpv1), einen protonenempfindlichen Kanal in somatosensorischen Trigeminusneuronen. Mäuse mit doppeltem KO zeigten eine deutlich höhere Neigung, an sauren Substanzen zu lecken - ein nahezu vollständiger Verlust der sauren Aversion. Diese Ergebnisse deuten auf zwei Erkennungssysteme hin: ein gustatorisches, über Typ-III-Zellen und SNAP25-vermittelte Synapsen, und ein somatosensorisches, über TRPV1-exprimierende Trigeminusfasern.
Interessanterweise reagierten sogar diese Mäuse mit doppeltem KO auf hohe Säurekonzentrationen, was auf die Existenz zusätzlicher Mechanismen zur Erkennung von saurem Geschmack hindeutet. Dabei könnte es sich um evolutionäre Redundanzen handeln, die sicherstellen, dass schädliche saure Substanzen auch dann noch erkannt werden können, wenn ein Geschmackswahrnehmungsweg ausfällt. Die Ergebnisse dieser Studie zeigen, wie sich die Wahrnehmung des sauren Geschmacks von anderen Geschmacksrichtungen unterscheidet, da sie in einzigartiger Weise von neuronenartigen vesikulären Synapsen abhängt. Damit untermauert die Studie, dass periphere Sinneszellen klassische synaptische Mechanismen nicht nur zur Informationsübertragung nutzen, sondern auch die Langlebigkeit der Zellen unterstützen können.
"Die Tatsache, dass SNAP25 nicht nur für die Freisetzung von Neurotransmittern unentbehrlich ist, sondern auch für die Langlebigkeit von sauren Sinneszellen, deutet auf eine umfassendere Rolle synaptischer Proteine bei der Aufrechterhaltung der Integrität sensorischer Epithelien hin", schließt Prof. Yoshida.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
"Dual functions of SNAP25 in mouse taste buds"; The Journal of Physiology, 2025.
























































