Neues Material ebnet den Weg für ferngesteuerte Medikamente und elektronische Pillen
Forschungsergebnisse in Produktentwicklung des Spin-offs Nyctea Technologies überführt
Anzeigen
Biomedikamente werden von lebenden Zellen hergestellt und unter anderem zur Behandlung von Krebs und Autoimmunkrankheiten eingesetzt. Eine Herausforderung besteht darin, dass die Medikamente sehr teuer in der Herstellung sind, was den weltweiten Zugang einschränkt. Jetzt haben Forscher von Chalmers ein Material erfunden, das elektrische Signale nutzt, um Biomoleküle einzufangen und freizusetzen. Die neue und effiziente Methode könnte einen großen Einfluss auf die Entwicklung von Biomedizin haben und den Weg für die Entwicklung von elektronischen Pillen und Medikamentenimplantaten ebnen.
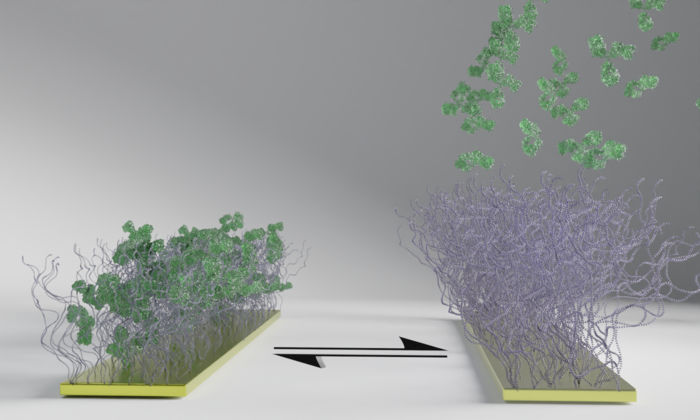
Die Polymeroberfläche, die im Bild als Bürsten zu sehen ist, reagiert auf einen elektrischen Impuls, indem sie die grünen Biomoleküle einfängt und wieder freigibt. Die Polymeroberfläche fängt die Biomoleküle zunächst ein (links) und gibt sie wieder frei, wenn der Strom eingeschaltet wird (rechts). Im Gegensatz zu den Biomolekülen bleiben die Polymerbürsten trotz des elektrischen Impulses haften, und der Vorgang kann wiederholt werden.
Illustration: Chalmers University of Technology | Gustav Ferrand-Drake del Castillo
Bei dem neuen Material handelt es sich um eine Polymeroberfläche, die auf einen elektrischen Impuls hin ihren Zustand ändert und Biomoleküle einfängt und freisetzt. Dies bietet mehrere Anwendungsmöglichkeiten, u. a. als Werkzeug zur effizienten Trennung eines Medikaments von den anderen Biomolekülen, die Zellen bei der Herstellung biologischer Arzneimittel bilden. Die Ergebnisse der Studie wurden kürzlich in der Fachzeitschrift Angewandte Chemie veröffentlicht.
Die Herstellung von Biomedikamenten ist sehr teuer, da es an einer effizienten Trenntechnik mangelt. Neue Techniken mit einer höheren Ausbeute an Medikamenten sind erforderlich, um die Produktionskosten und letztlich die Kosten für die Behandlung von Patienten zu senken.
"Unsere Polymeroberflächen bieten einen neuen Weg zur Trennung von Proteinen, indem sie mit Hilfe von elektrischen Signalen steuern, wie sie an eine Oberfläche gebunden und wieder freigesetzt werden, ohne die Struktur des Proteins zu beeinträchtigen", sagt Gustav Ferrand-Drake del Castillo, der seine Doktorarbeit in Chemie an der Chalmers University öffentlich verteidigt hat und der Hauptautor der Studie ist.
Die herkömmliche Trenntechnik - die Chromatographie - bindet Biomoleküle fest an die Oberfläche, und es sind starke Chemikalien erforderlich, um sie freizusetzen, was zu Verlusten und einer geringen Ausbeute führt. Viele neue Medikamente haben sich als sehr empfindlich gegenüber starken Chemikalien erwiesen, was ein großes Produktionsproblem für die nächste Generation von Biomedikamenten darstellt. Der geringere Verbrauch von Chemikalien kommt der Umwelt zugute, und die Tatsache, dass die Oberflächen des neuen Materials in mehreren Zyklen wiederverwendet werden können, ist eine wichtige Eigenschaft. Der Prozess kann Hunderte von Malen wiederholt werden, ohne dass die Oberfläche beeinträchtigt wird.
Funktionen in biologischen Flüssigkeiten
Das Material funktioniert auch in biologischen Flüssigkeiten mit Pufferkapazität, d. h. in Flüssigkeiten, die in der Lage sind, Änderungen des pH-Werts entgegenzuwirken. Diese Eigenschaft ist bemerkenswert, da sie den Weg für eine neue Technik für Implantate und elektronische "Pillen" ebnet, die das Medikament über eine elektronische Aktivierung an den Körper abgeben.
"Man kann sich vorstellen, dass ein Arzt oder ein Computerprogramm den Bedarf an einer neuen Medikamentendosis bei einem Patienten misst und ein ferngesteuertes Signal die Freisetzung des Medikaments aus dem Implantat aktiviert, das sich genau in dem Gewebe oder Organ befindet, in dem es benötigt wird", erklärt Gustav Ferrand-Drake del Castillo.
Lokale, aktivierte Wirkstofffreisetzung gibt es heute in Form von Materialien, die ihren Zustand bei einer Veränderung des chemischen Umfelds ändern. So werden beispielsweise Tabletten aus pH-empfindlichem Material hergestellt, wenn man die Freisetzung eines Medikaments im Magen-Darm-Trakt steuern will, einer Umgebung mit natürlichen Schwankungen des pH-Werts. In den meisten Geweben des Körpers gibt es jedoch keine Veränderungen des pH-Werts oder anderer chemischer Parameter.
"Wir glauben, dass die Möglichkeit, die Freisetzung und Aufnahme von Proteinen im Körper mit minimalen chirurgischen Eingriffen und ohne Injektionen zu steuern, eine einzigartige und nützliche Eigenschaft ist. Die Entwicklung von elektronischen Implantaten ist nur eine von mehreren denkbaren Anwendungen, die noch viele Jahre in der Zukunft liegen. Die Forschung, die uns hilft, die Elektronik mit der Biologie auf molekularer Ebene zu verbinden, ist ein wichtiges Puzzlestück in dieser Richtung", sagt Gustav Ferrand-Drake del Castillo.
Ein weiterer Vorteil der neuen Methode ist, dass sie keine großen Mengen an Energie benötigt. Der geringe Stromverbrauch ist darauf zurückzuführen, dass die Tiefe des Polymers auf der Oberfläche der Elektrode sehr dünn ist, im Nanometerbereich, was bedeutet, dass die Oberfläche sofort auf kleine elektrochemische Signale reagiert.
"Elektronik in biologischen Umgebungen ist oft durch die Größe der Batterie und die beweglichen mechanischen Teile begrenzt. Die Aktivierung auf molekularer Ebene verringert sowohl den Energiebedarf als auch den Bedarf an beweglichen Teilen", sagt Gustav Ferrand-Drake del Castillo.
Der Durchbruch begann mit einer Doktorarbeit
Die Forschungsarbeiten, die der Technik zugrunde liegen, wurden während der Zeit durchgeführt, als Ferrand-Drake del Castillo Doktorand im Forschungsteam von Chalmers-Professor Andreas Dahlin in der Abteilung für angewandte Oberflächenchemie war. Bei dem Projekt ging es um Polymeroberflächen, die je nach dem pH-Wert der sie umgebenden Lösung ihren Zustand zwischen neutral und geladen ändern. Den Forschern gelang es dann, ein Material zu schaffen, das stark genug ist, um bei wiederholten elektrischen Signalen auf der Oberfläche zu bleiben, und das gleichzeitig dünn genug ist, um den pH-Wert infolge der Elektrochemie auf der Oberfläche tatsächlich zu verändern.
"Kurz darauf entdeckten wir, dass wir die elektrischen Signale nutzen können, um die Bindung und Freisetzung von Proteinen und Biomolekülen zu steuern, und dass das Elektrodenmaterial in biologischen Lösungen wie Serum und zentrifugiertem Blut funktioniert. Wir glauben und hoffen, dass unsere Entdeckungen für die Entwicklung neuer Medikamente von großem Nutzen sein können", sagt Andreas Dahlin.
Im vergangenen Jahr wurden die Ergebnisse der Chalmers-Forscher in die Produktentwicklung des Spin-off-Unternehmens Nyctea Technologies überführt. Das Unternehmen hat bereits Kunden unter den führenden pharmazeutischen Forschern und Unternehmen.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Da tut sich was in der Life-Science-Branche …
So sieht echter Pioniergeist aus: Jede Menge innovative Start-ups bringen frische Ideen, Herzblut und Unternehmergeist auf, um die Welt von morgen zum Positiven zu verändern. Tauchen Sie ein in die Welt dieser Jungunternehmen und nutzen Sie die Möglichkeit zur Kontaktaufnahme mit den Gründern.
























































