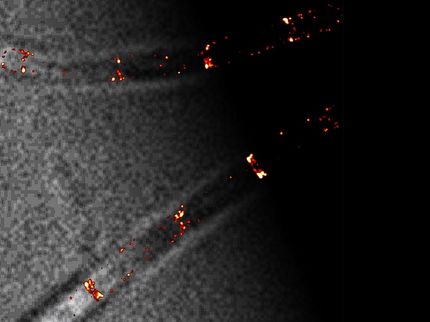
Neue Mikroskopie-Methode ermöglicht 3D-Verfolgung von 100 einzelnen Molekülen auf einmal
Vielseitige Technologie
Anzeigen
Seit seiner Erfindung vor über 400 Jahren hat sich das Mikroskop ständig weiterentwickelt und lässt uns immer tiefer in die Geheimnisse der Natur blicken.

Die Grafik zeigt den grundlegenden Versuchsaufbau für die Oberflächenplasmonenresonanzmikroskopie (SPRM). Wenn ein interessierendes Teilchen an einen Rezeptor bindet, der an einen dünnen Goldfilm gebunden ist, stört dieses Ereignis eine Oberflächenplasmonenwelle, die als Änderung der Lichtintensität registriert wird. Die Lichtquelle ist eine SLED (für Superluminescent Emitting Diode), die die Probe beleuchtet und eine Oberflächenplasmonenwelle auslöst, die sich über die Goldoberfläche ausbreitet. Eine Hochgeschwindigkeitskamera fängt diese schnellen Veränderungen ein und bildet die Bindungsdynamik ab.
Adapted with permission from Three-Dimensional Tracking of Tethered Particles for Probing Nanometer-Scale Single-Molecule Dynamics Using a Plasmonic Microscope Copyright 2021 American Chemical Society.
In einer neuen Forschungsarbeit beschreiben Prof. Shaopeng Wang, sein Postdoktorand Guangzhong Ma und ihre Kollegen vom Biodesign Center for Bioelectronics and Biosensors an der Arizona State University Fortschritte in der Mikroskopie, die auf einem als Oberflächenplasmonenresonanz (SPR) bekannten Phänomen beruhen.
Die neue Studie hebt eine Reihe von Experimenten hervor, die zeigen, wie die SPR-Technologie genutzt werden kann, um 100 einzelne Moleküle gleichzeitig präzise abzubilden und ihre dynamischen Aktivitäten in Echtzeit zu beschreiben, insbesondere wenn Moleküle sich miteinander verbinden und wichtige biologische Funktionen ausüben.
"Unter Ausnutzung der extrem hohen Empfindlichkeit in axialer (vertikaler) Richtung kann die SPR die axialen Bewegungen der Partikel mit einer Präzision im Sub-Nanometerbereich verfolgen, was viel präziser ist als die herkömmliche Mikroskopie", sagt Wang. "Wir haben gezeigt, dass diese Eigenschaft genutzt werden kann, um die Details von molekularen Bindungsereignissen auf Einzelmolekülebene zu untersuchen und auch um mehrere Signale gleichzeitig zu verarbeiten."
Wissenschaft auf neuen Wegen
SPR ist ein optischer Effekt, mit dem sich die Bindung von Molekülen nachweisen und präzise messen lässt, ohne dass fluoreszierende Markierungen erforderlich sind. Die Technik hat ein breites Anwendungsspektrum, sowohl in der Industrie als auch in der Medizin, wo sie zum Screening und zur Entwicklung neuer pharmazeutischer Wirkstoffe und Biotherapeutika, neuer diagnostischer Tests und zur Entschlüsselung einiger Krankheitsmechanismen eingesetzt werden kann.
Viele für Gesundheit und Krankheit wichtige Biomoleküle sind mit herkömmlichen Techniken wie Röntgenkristallographie oder NMR-Spektroskopie nur schwer zu beobachten. SPR bietet eine effiziente und kostengünstige Alternative für diese Untersuchungen.
SPR beruht auf der Tatsache, dass Metalle viele Elektronen enthalten, die nicht an Atome gebunden sind. Wenn diese freien Elektronen unter den richtigen Bedingungen mit Licht bestrahlt werden, bringt die im Licht enthaltene Energie diese Elektronen in Resonanz und erzeugt eine Welle auf der Metalloberfläche, die als Oberflächenplasmon bezeichnet wird.
Die SPR-Technik kann zur Messung der Bindung zwischen Proteinen, Nukleinsäuren, kleinen Molekülen und vielen anderen Wechselwirkungen eingesetzt werden. Präzise Untersuchungen solcher Biomoleküle sind eine Herausforderung, da die meisten nur wenige Nanometer groß sind. Die daraus resultierenden Daten können den Forschern dabei helfen festzustellen, welche Moleküle in einer Probe interagieren, warum sie interagieren und wie stark diese Interaktionen sind.
SPR ist eine der wenigen Techniken, die es Forschern ermöglicht, nicht nur die Bindungsaffinität von Molekülen zu untersuchen, sondern auch ihre Bindungskinetik, was wertvolle Informationen liefert, die von herkömmlichen Tests wie ELISA nicht erfasst werden. Die Oberflächenplasmonenresonanzmikroskopie (SPRM) geht noch einen Schritt weiter und stellt eine äußerst vielseitige Technologie zur Untersuchung molekularer Bindungsvorgänge im Subnanometerbereich und mit einer Zeitauflösung von Millisekunden dar.
Empfindliche Nachweise
Um mit SPR die Bindung eines einzelnen Moleküls zu untersuchen, wird das Rezeptormolekül, z. B. ein kurzes DNA-Segment, auf einer Sensoroberfläche aus einer sehr dünnen Goldschicht immobilisiert. Dann wird das bindende Molekül in eine wässrige Lösung gegeben.
Wenn polarisiertes Licht im richtigen Winkel auf die Goldschicht gerichtet wird, werden plasmonische Wellen erzeugt. Ein Bindungsereignis zwischen dem immobilisierten Rezeptor und dem Bindungsmolekül kann nachgewiesen werden, wenn es den Brechungsindex an der Goldoberfläche verändert. Dieser Effekt bewirkt eine Störung des Oberflächenplasmonen, was zu einer Erhöhung der Signalintensität führt. Diese flüchtigen Effekte werden dann mit Hilfe von Hochgeschwindigkeitskameras aufgezeichnet.
In der aktuellen Studie wurde die SPR-Bildgebung verwendet, um 100 Partikel gleichzeitig in drei Dimensionen zu verfolgen. In einem Experiment dienten gebundene Doppelstrang-DNA-Segmente mit einer Länge von 48 Basenpaaren, die auf einer Goldoberfläche angebracht waren, als Rezeptormoleküle. Das Molekül, das sie aufspüren wollten, war ein kleines Enzym, eine so genannte Helikase. Seine Aufgabe in biologischen Systemen besteht darin, an die DNA zu binden und sie abzuwickeln, wenn Reparaturen an der DNA-Sequenz erforderlich sind.
Die DNA-Helikase wurde zunächst an ein Goldnanopartikel gebunden, damit die SPR ihre subtilen optischen Eigenschaften bei der Bindung an den angebundenen DNA-Strang aufzeigen konnte.
Nach Zugabe von ATP in die wässrige Lösung machte sich die Helikase an die Arbeit und wickelte die doppelsträngige DNA mit einer Geschwindigkeit von etwa 10 Basenpaaren pro Sekunde ab, wobei die Live-Aktion von einer Kamera mit 400 Bildern pro Sekunde aufgezeichnet wurde. Die in der Studie beschriebene hochpräzise 3D-Verfolgungsmethode ermöglichte es den Forschern, die Abwicklungsgeschwindigkeit des DNA-Strangs sowie den Drehwinkel des gebundenen Helikase-Moleküls zu bestimmen.
Vielseitige Technologie
Andere Experimente zeigen, dass die Methode einen partikelbasierten Nachweis der Antikörper-Antigen-Bindung ermöglicht und zwischen spezifischen und unspezifischen Bindungsereignissen unterscheiden kann. (Eine unspezifische Antikörperbindung kann auftreten, wenn einer Zelle ein Rezeptor oder Epitop für einen spezifischen Antikörper fehlt.) Hier wurde das Molekül Troponin T, ein gängiger Biomarker für Herzkrankheiten, bei der Bindung an den entsprechenden, auf der Goldoberfläche angebrachten Antikörper beobachtet.
Die Fähigkeit, spezifische von unspezifischen Bindungsereignissen zu trennen, ist ein wertvoller Vorteil, da letztere häufig in gemischten Proben wie Serum auftreten, was eine genaue diagnostische Analyse erschwert.
Da das SPRM-Verfahren außerdem Daten von 100 Molekülen gleichzeitig in drei Dimensionen erfassen kann, ermöglicht es eine detaillierte statistische Analyse der molekularen Bindungsereignisse und -kinetik, die mit herkömmlichen Methoden nicht möglich ist. Die neue Technik ist daher sehr vielversprechend für den schnellen, kostengünstigen und detaillierten Nachweis von Biomolekülen und könnte in eine neue Generation von Biosensorgeräten integriert werden.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.