RNA-Moleküle in Raum und Zeit beobachten
Ganz neue Wege, um beispielsweise die Wirkungsweise medikamentöser Therapien zu erforschen
Anzeigen
Einem MDC-Team ist es gelungen, im Einzellembryo des Zebrafisches Gene in Raum und Zeit zu beobachten – noch bevor die Zellteilung einsetzt. Im Fachjournal „Nature Communications“ stellen sie eine Methode vor, mit der künftig beispielsweise auch in Organoiden gemessen werden könnte, wie Zellen auf Medikamente reagieren.
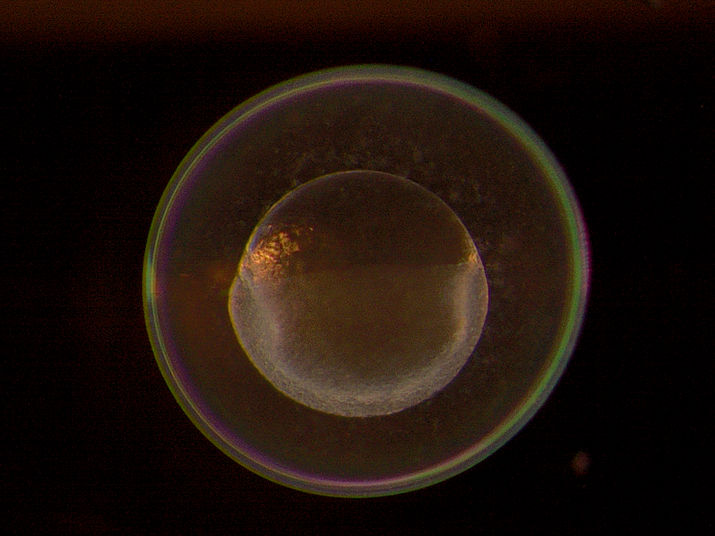
Einzellembryo des Zebrafisches: Die MDC-Forschungsgruppe fand darin zahlreiche lokalisierte Gene. Viele ihrer Erbinformationen wandern in die Vorläuferzellen der späteren Keimzellen.
© AG Junker, MDC
Zu keinem späteren Zeitpunkt offenbart sich das „Wunder des Lebens“ so sehr wie an seinem Anfang: wenn die befruchtete Eizelle sich zu Blastomeren furcht, mit einer Fruchtblase umhüllt, Keimblätter ausfaltet. Wenn die Blastomere beginnen, zu unterschiedlichen Zellen zu differenzieren. Wenn aus ihnen schließlich ein kompletter Organismus wird.
„Wir wollten herausfinden, ob die späteren Unterschiede zwischen den verschiedenen Zellen zum Teil bereits in der befruchteten Eizelle angelegt sind“, sagt Dr. Jan Philipp Junker, der am Berliner Institut für Systembiologie (BIMSB) des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) die Arbeitsgruppe „Quantitative Entwicklungsbiologie“ leitet. Mit seinem Team untersucht Junker, wie Zellen Entscheidungen treffen und wovon es abhängt, ob sie zu Nerven-, Muskel- oder Hautzellen werden. Dafür erstellen die Wissenschaftler Stammbäume von Zellen, mit denen sie Herkunft und Zelltyp für Tausende einzelner Zellen aus einem Organismus bestimmen können. Anhand dieser Stammbäume können sie nachvollziehen, wie und auf welchen Wegen Zellen sich zu einem funktionierenden Organismus zusammenfügen oder wie sie auf Störungen reagieren.
Baupläne für verschiedene Zelltypen stecken schon im Einzellembryo
Doch diese Spurensuche mittels Zellstammbäumen setzt an einem späteren Zeitpunkt an – nämlich dann, wenn Zellteilung und -differenzierung eingesetzt haben. Zudem werden dabei große Zeiträume – über Monate oder Jahre hinweg – betrachtet. In ihrer aktuellen Studie legt Junkers Forschungsgruppe ihr Augenmerk auf eine sehr kurze Zeitspanne: auf die ersten Stunden nach der Befruchtung, vom Einzellstadium bis zur Gastrulation – der Ausbildung der Keimblätter – des Embryos. Die Wissenschaftler wollten wissen, ob in der einzelnen Zelle bereits Teile des Bauplans für die vielen verschiedenen Körperzellen stecken, die sich später aus ihr bilden. Sie arbeiteten dafür mit Zebrafisch- und mit Klauenfroschembryonen. Schon zuvor war es Forschenden gelungen, einzelne Gene zu finden, deren RNA innerhalb der Einzellembryonen des Zebrafisches an bestimmten Stellen lokalisiert ist. Die Berliner Wissenschaftler haben nun nachgewiesen, dass es noch viel mehr solcher Gene gibt. „Wir haben zehnmal mehr Gene entdeckt als bislang bekannt, deren RNA in der befruchteten Eizelle räumlich lokalisiert ist“, erklärt Karoline Holler, Erstautorin der Studie. „Viele dieser RNA-Moleküle werden später in die Vorläuferzellen der Keimzellen transportiert. Das bedeutet, dass schon in der befruchteten Eizelle das Programm für die spätere Zelldifferenzierung angelegt ist.“
Neue Ansätze für die Transkriptomik
Die Zelldifferenzierung lässt sich mit modernen Methoden der Einzelzell-Transkriptomik sehr gut nachvollziehen. Wissenschaftler ordnen dafür einzelne Zellen nach der Ähnlichkeit ihrer Transkriptome – das sind sämtliche in der Zelle enthaltenen RNA-Moleküle – und können anhand der sich dabei bildenden Muster bestimmen, auf welchen Wegen die Zellen zu dem geworden sind, was sie sind. Die ersten Schritte in der Embryonalentwicklung können sie damit allerdings nicht nachvollziehen, denn hier ist die räumliche Anordnung von RNA-Molekülen entscheidend. Dafür griff das Team auf eine Technik namens „Tomo-seq“ zurück, die Jan Philipp Junker 2014 am Hubrecht Institute in den Niederlanden entwickelt hat. Damit ist es möglich, RNA-Moleküle räumlich innerhalb der Zelle zu verfolgen. Das funktioniert, indem die Wissenschaftler Embryonen der Modellorganismen in dünne Scheiben schneiden. Entlang der Schnittflächen können sie die RNA-Profile ablesen und in räumliche Expressionsmuster umrechnen. Karoline Holler verfeinerte diese Technik so, dass nun auch die räumliche Verteilung des Transkriptoms in der befruchteten Eizelle gemessen werden kann.
Mit einer zweiten neuen Methode untersuchten die Wissenschaftler, zu welchen Zellen die lokalisierten Gene später beitragen. „Um die RNA-Moleküle über verschiedene Entwicklungsstadien zu verfolgen, markieren wir sie. So können wir sie nicht nur im Raum, sondern auch im Lauf der Zeit beobachten“, erläutert Jan Philipp Junker. Auf diese Weise können die Wissenschaftler die RNA, die seitens der Mutter in den Embryo gelegt wird, von der RNA unterscheiden, die der Embryo selbst bildet. Diese „scSLAM-seq“ genannte Methode zur Markierung von RNA wurde am BIMSB in den Arbeitsgruppen von Professor Markus Landthaler und Professor Nikolaus Rajewsky verbessert, so dass nun eine Anwendung im lebenden Zebrafisch möglich ist. „Das Labeling von RNA-Molekülen erlaubt es uns, mit hoher Präzision zu messen, wie sich die Genexpression in einzelnen Zellen verändert, beispielsweise nach einem experimentellen Eingriff“, erläutert Junker.
Wie wirken sich Medikamente auf die Zelldifferenzierung aus?
Mit RNA-Labeling eröffnen sich ganz neue Wege, um beispielsweise die Wirkungsweise medikamentöser Therapien zu erforschen. „Wir können damit in Organoiden untersuchen, wie verschiedene Zelltypen auf Substanzen reagieren“, erklärt der Physiker. Für langfristige Veränderungsprozesse sei die Methode nicht geeignet. „Aber wir sehen, welche Gene sich innerhalb von fünf bis sechs Stunden nach der Behandlung verändern. So können wir versuchen zu verstehen, wie wir die Zelldifferenzierung beeinflussen können .“
Auch die räumliche Analyse hat medizinische Relevanz: Auf lange Sicht könnte sie für die Erforschung solcher Krankheiten geeignet sein, die auf fehllokalisierte RNA zurückzuführen sind, beispielsweise Krebs oder neurodegenerative Erkrankungen. Bei ihnen werden viele Moleküle durch die Zelle transportiert. „Wenn wir diese Transportprozesse verstehen, dann können wir möglicherweise Risikofaktoren für diese Krankheiten bestimmen“, erklärt Karoline Holler. Doch das ist Zukunftsmusik. „Bis der Zebrafisch-Einzellembryo als Modellsystem für menschliche neurodegenerative Erkrankungen genutzt werden kann, ist es noch ein sehr weiter Weg“, betont Jan Philipp Junker.
Vorerst wollen die Wissenschaftler die Mechanismen zur Lokalisierung der RNA entschlüsseln: Worin unterscheidet sich die aufgespürte RNA von den Transkripten, die sonst noch in der Zelle stecken? Zusammen mit der Arbeitsgruppe von Professorin Irmtraud Meyer am BIMSB will Junkers Team die Sequenzmerkmale der lokalisierten RNA charakterisieren. Mithilfe von Algorithmen wollen sie vorhersagen, ob die lokalisierten Gene eine zwei- oder dreidimensionale Faltung gemeinsam haben. Darüber hinaus arbeiten sie daran, ihre Methode so weiterzuentwickeln, dass sie auch in anderen Systemen als dem Zebrafisch-Einzellembryo zum Einsatz kommen kann.