Zellulärer 'Tuning-Mechanismus' baut elegante Augen
Eine molekulare "Bremse" hilft die Entwicklung der Augenlinse bei Zebrafischen zu kontrollieren
Anzeigen
Wie verschiedene Zellen in einem multizellulären Organismus ihre Identität erlangen, bleibt ein grundlegendes Geheimnis der Entwicklung. Im Auge zum Beispiel enthält die Linse zwei Zelltypen - Linsenepithelzellen und Linsenfaserzellen - von denen sich der erste in den zweiten differenziert, wenn ein Tier heranreift. Wissenschaftler wissen seit langem, dass der Fibroblasten-Wachstumsfaktor, kurz FGF, als Hauptantrieb für diesen Prozess dient. Jetzt haben Wissenschaftler des Okinawa Institute of Science and Technology Graduate University (OIST) herausgefunden, dass ein anderes molekulares Signal wie ein Bremspedal wirkt und verhindert, dass Zellen dort differenzieren, wo sie nicht hin sollten.
Das Team führte ihre Experimente mit Zebrafischen durch, deren Augenstruktur bei Wirbeltieren, einschließlich Menschen, grundsätzlich erhalten ist. Ihre Ergebnisse geben neue Einblicke in den komplexen Prozess der Zelldifferenzierung.
"Wissenschaftler sind neugierig zu wissen, wie eine so elegante Struktur durch ein genetisches Programm aufgebaut ist", sagt Prof. Ichiro Masai, Leiter der Abteilung für Entwicklungsneurobiologie am OIST.
Neben der Entmystifizierung der Linsenentwicklung kann die Forschung eines Tages helfen, die Pathologie hinter dem sekundären Katarakt aufzudecken, der häufigsten Komplikation der Kataraktoperation beim Menschen.
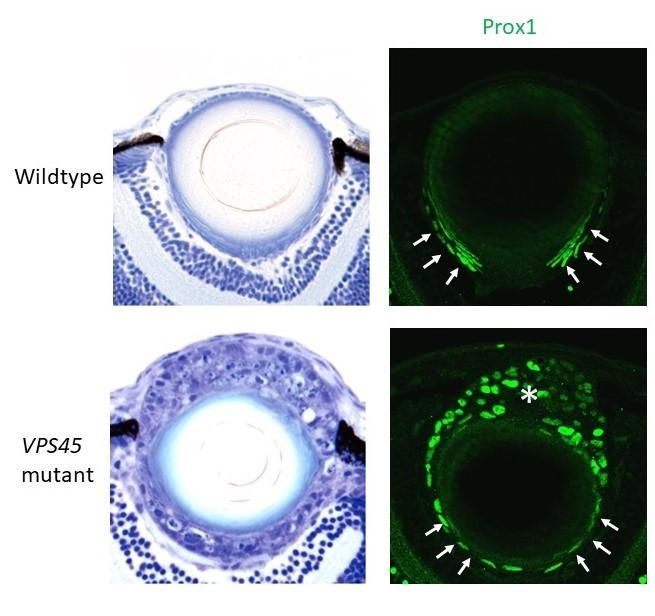
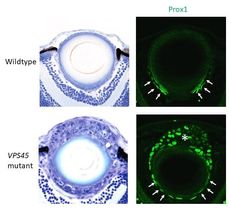
Wildtyp-Linsenentwicklung (oben) im Vergleich zur Mutation VPS45 (unten). Die Differenzierung der Faserzellen ist grün markiert.
OIST
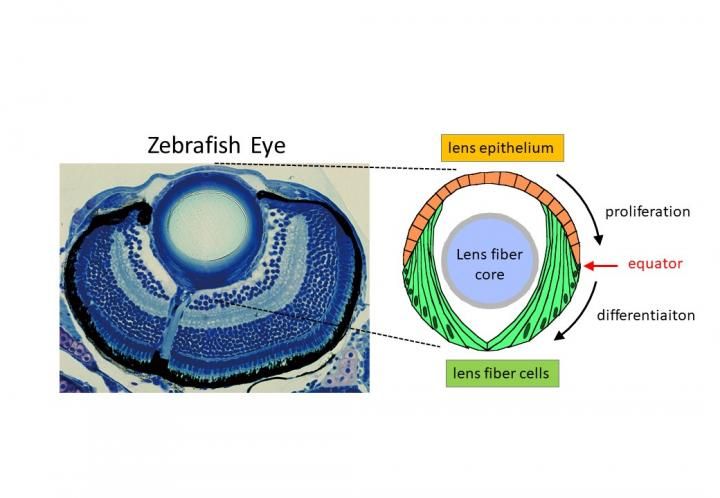
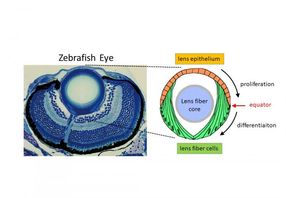
Diagramm der Zebrafischlinse. Der rote Pfeil zeigt auf den Linsenäquator.
OIST
Eine Ergänzung zu den bekannten Regulatoren
Die sphärische Linse besteht meist aus Linsenfaserzellen, die in einem dicht gepackten Kern angeordnet sind. Epithelzellen der Linse bedecken die äußerste Oberfläche der vorderen Hälfte der Linse, nach außen gerichtet vom Körper. Während sich die Linsenepithelzellen vermehren, wandern sie rückwärts, differenzieren sich zu Linsenfaserzellen und integrieren sich in den vorhandenen Linsenfaserkern.
Der Wechsel von einem Zelltyp zum anderen erfolgt während dieser Migration, wenn Epithelzellen eine bestimmte Grenze überschreiten, die als "Äquator" bezeichnet wird. Molekulare Hinweise treiben die Zellen dazu, sich zu Linsenfaserzellen zu entwickeln, sobald sie diese Linie überschritten haben. Ein wichtiger Anhaltspunkt ist die FGF. Während FGF die Differenzierung der Linsenfasern fördert, fragte sich Masai, ob es ein ergänzendes System gäbe, das sie unterdrückt.
"Der Wechsel von Epithel zu Faserzellen erfolgt sehr genau am Äquator - ich dachte, es müsste einen Abstimmmechanismus geben, um den äquatorspezifischen Beginn zu gewährleisten", sagt Masai. "Vielleicht werden Epithelzellen, sobald sie den Äquator überqueren, von diesem Hemmmechanismus befreit und dürfen sich differenzieren."
Forscher der OIST Developmental Neurobiology Unit unterhalten eine lebendige Bibliothek von mutierten Zebrafischen für Studien wie diese. Unter Hunderten von Mutanten wählten sie eine mit einzigartig abnormaler Linsenentwicklung aus. Linsenepithelzellen bilden in der Regel eine einzige kontinuierliche Schicht, aber in den Mutanten stapeln sich die Zellen zu einer zufälligen Masse. Denn ein mutiertes Gen bewirkt, dass sich Linsenepithelzellen unabhängig von der FGF-Exposition differenzieren, ohne den Äquator überqueren zu müssen.
Das Gen kodiert normalerweise ein Protein, das als "vacuolar protein sorting-associated protein 45" oder VPS45 bekannt ist. VPS45 hilft, eingehende Materialien durch die Zelle zu leiten und sie an spezialisierte Organellen zum Abbau oder zurück zur Zellmembran zum Recycling zu leiten. Neuere Studien deuten darauf hin, dass dieses Trafficking-System Signalwege innerhalb der Zelle moduliert, die wiederum Entwicklungsprozesse regulieren.
Wenn das Gen jedoch mutiert ist, wird die normale Linsenentwicklung gestört. Spezifische Signale, die Linsenepithelzellen erhalten, werden unterdrückt, während Signale, die die Differenzierung von Faserzellen fördern, verstärkt werden.
Anwendung in der Grundlagenforschung und Kataraktchirurgie
Masais Studie ist die erste, die einen Mechanismus zur Differenzierung von Linsenfasern beschreibt, der unabhängig von FGF ist. Er und seine Kollegen wollen nun besser verstehen, wie VPS45 die zelluläre Signalübertragung in der Entwicklungslinse reguliert und wie diese Signale zusammenwirken, um eine gesunde Entwicklung zu unterstützen. Ihre Forschung könnte schließlich zu medizinischen Interventionen führen, wenn der Prozess schief geht.
In der neuen Studie fanden die Wissenschaftler beispielsweise heraus, dass ein Signalweg namens TGF-ß im mutierten Zebrafisch verstärkt wurde und eine abnormale Linsenentwicklung verursachte. TGF-ß-Signale tragen nachweislich auch zum sekundären Grauen Star bei, aber Wissenschaftler verstehen noch nicht, warum.
Bei der Kataraktoperation wird die getrübte Linse eines Patienten durch eine künstliche ersetzt. Die Operation stellt das Sehvermögen des Patienten wieder her, kann aber auch eine angeborene Heilungsreaktion in Linsenepithelzellen auslösen. Um die Wunde zu heilen, verwandeln sich die Zellen in myofibroblastische Zellen oder Linsenfaserzellen und trüben so die brandneue Linse des Patienten. Mit einem tieferen Verständnis der Faktoren, die die Entwicklung der Linse vorantreiben, könnten Wissenschaftler den sekundären Grauen Star umgehen, bevor sie beginnen.
"Sobald wir diesen zugrunde liegenden Mechanismus verstehen", sagte Masai, "könnten wir eine Therapie entwickeln, um den pathologischen Prozess des sekundären Katarakts zu hemmen."





















































