Gerüst von Proteinflecken im Zellkern nach 100 Jahren identifiziert
Was die Körnchen im Kern zusammenhält
Anzeigen
Nuclear Speckles sind winzige Zusammenballungen von Proteinen im Kern der Zelle, die an der Verarbeitung genetischer Information beteiligt sind. Berliner Forschende zeigen nun, wie die Speckles aufgebaut sind und konnten dabei eine langjährige Wissenslücke schließen.
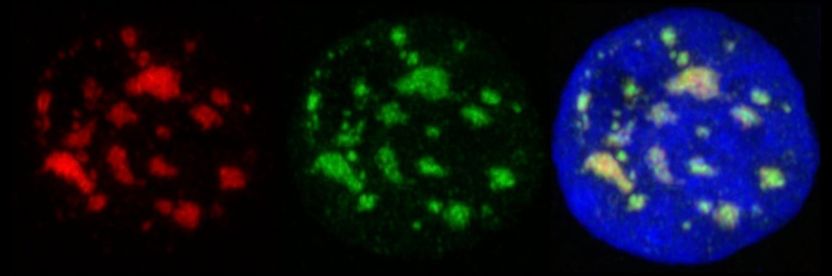
Menschlicher Zellkern unter dem Mikroskop: Eine spezifische Färbung von SON (rot; linkes Bild) und SRRM2/SC35 (grün; mittleres Bild) zeigt, wo sich die Nuclear Speckles (rechtes Bild) im Verhältnis zur DNA der Zelle (blau) befinden. Der Kern hat einen Durchmesser von etwa 10 Mikrometern, was einem hundertstel Millimeter entspricht.
Ibrahim Ilik, MPI f. molek. Genetik
Als der berühmte spanische Mediziner Santiago Ramón y Cajal 1910 durch sein Mikroskop schaute, entdeckte er unregelmäßige und „durchsichtige Klümpchen“, die den Zellkern einer Nervenzelle durchsetzten. Seitdem haben Biologie und Medizin mehrere Revolutionen durchlaufen, aber was es mit diesen Kernsprenkeln (engl. Nuclear Speckles) auf sich hat, ist immer noch weitgehend unklar.
„Auch wenn wir inzwischen einiges über ihre Funktion gelernt haben – bisher wussten wir nicht, wie die Speckles aufgebaut sind, oder was sie im Kern zusammenhält“, sagt Tuğçe Aktaş vom Max-Planck-Institut für molekulare Genetik in Berlin.
Das Team um die Max-Planck-Forschungsgruppenleiterin zeigt nun im Fachjournal eLife erstmals, welche Moleküle das Gerüst für die Speckles bilden. Es handelt sich um die zwei Proteine SON und SRRM2, die es in verschiedenen Ausprägungen im gesamten Tierreich gibt. Sie sind an der Verarbeitung von RNA beteiligt, die entsteht, wenn Gene abgelesen werden. Fehlen diese beiden Proteine, lösen sich die Speckles auf.
Anders als andere Strukturen der Zelle besitzen Nuclear Speckles keine abgrenzende Membranhülle, sondern bestehen aus einer Zusammenballung von Molekülen, die sich dynamisch auflösen und neu entstehen kann. So weisen sie sowohl die Eigenschaften von Feststoffen als auch von Flüssigkeiten auf. Solche „Kondensat“ genannte Körperchen gibt es in der Zelle viele. „Jedes Kondensat-Körperchen enthält einen Kern aus einer Sorte Proteinen – im Fall der Speckles sind es eben zwei Proteine“, sagt Aktaş.
Von der falschen Fährte auf den richtigen Weg
Es sei kein Zufall, dass bislang alle Versuche, den kleinsten gemeinsamen Nenner der mysteriösen Strukturen zu identifizieren, gescheitert seien: „Seit 30 Jahren wurden diese Strukturen mit einem Reagenz angefärbt, dessen Eigenschaften nicht besonders gut bekannt waren“, sagt Aktaş. „Wir Forschende sind jahrzehntelang im Dunkeln getappt, allerdings ohne dass wir es wussten.“
So wurden die Speckles seit Anfang der neunziger Jahre weithin mit einer Substanz namens SC35 sichtbar gemacht. Es handelt sich dabei um einen Antikörper, der sich spezifisch an bestimmte Stellen in den Körnchen anheftet und diese mit Hilfe von zusätzlichen Farbstoffen auch markieren kann. Bisher war man jedoch davon ausgegangen, dass der Antikörper ausschließlich das kleine Protein SRSF2 erkennt – eine Annahme, die sich nun als falsch herausstellte.
„Wir wollten mit Hilfe des Antikörpers Speckles aus der Zelle heraus angeln wie mit einen Köder“, sagt İbrahim Avşar Ilık, der Erstautor der Studie. „Umso überraschter waren wir, dass das Protein SRRM2 angebissen hat, das wir dort gar nicht vermuteten.“ Es stellte sich heraus, dass der Antikörper nicht nur an das bereits bekannte SRSF2 haftet, sondern vor allem – und deutlich kräftiger – an SRRM2.
Auf der Suche im evolutionären Stammbaum
Obwohl die Sequenz von SRRM2 bei verschiedenen Tierarten stark variiert, besitzt das Protein einen kleinen Abschnitt, der sich über die Jahrmillionen der Evolution erhalten hat. Bei der Suche nach ähnlichen Proteinen im evolutionären Stammbaum fiel den Forscherinnen und Forschern zudem das Protein SON auf, das auch von anderen Arbeitsgruppen als möglicher Bestandteil der Speckles in Betracht gezogen wurde. „So kamen wir auf die Idee, dass genau diese beiden Proteine zusammen die essentiellen Bausteine der Speckles sein könnten“, sagt Ilık.
Um seine Hypothese zu testen, kultivierte das Team menschliche Zellen, in denen sie entweder das Gen für SRRM2 oder jenes für SON ausschalteten. Von den Speckles blieben infolgedessen nur kugelige Überbleibsel erhalten. Als die Forschenden anschließend in einer Zellkultur die Gene für beide Proteine gleichzeitig deaktivierten, lösten sich die Klümpchen vollständig auf. Die übrigen in den Speckles enthaltenen Proteine fanden sich anschließend im gesamten Zellkern verteilt. „Daraus folgern wir, dass SRRM2 und SON das Gerüst für die Nuclear Speckles bilden müssen“, sagt Ilık. „Als Nächstes wollen wir untersuchen, auf welche Art und Weise sich die beiden Proteine mit anderen Molekülen zusammenballen und wie dieser Vorgang gesteuert wird.“
Historische Fehlinterpretation mit Folgen
Die Ergebnisse haben aber noch mehr und vielleicht weitreichende Konsequenzen. „Da nun klar ist, dass der SC35-Antikörper primär an ein anderes Protein andockt als bisher vermutet, müssen frühere Forschungsergebnisse über Nuclear Speckles in einem neuen Licht betrachtet werden“, sagt Aktaş.
Der Antikörper SC35 wurde häufig auch bei der Erforschung von Krankheiten eingesetzt.
Nuclear Speckles sind an mehreren neurodegenerativen Leiden beteiligt, wie zum Beispiel Chorea Huntington, Spinozerebellärer Ataxie oder Dentatorubro-Pallidoluysischer Atrophie. „Womöglich ergeben sich nun neue Perspektiven für die Erforschung dieser Krankheiten“, sagt Aktaş.