Komplexer Regelkreis schützt vor Krebs
Chaperone halten das Tumorsuppressor-Protein p53 in Schach
Anzeigen
Über Leben und Tod einer Zelle entscheidet das Anti-Tumor-Protein p53: Erkennt es Schäden im Erbgut, treibt es die Zelle in den Selbstmord. Eine neue Forschungsarbeit an der Technischen Universität München (TUM) zeigt, dass diese körpereigene Krebsabwehr nur funktioniert, wenn bestimmte Proteine, die Chaperone, dies zulassen.
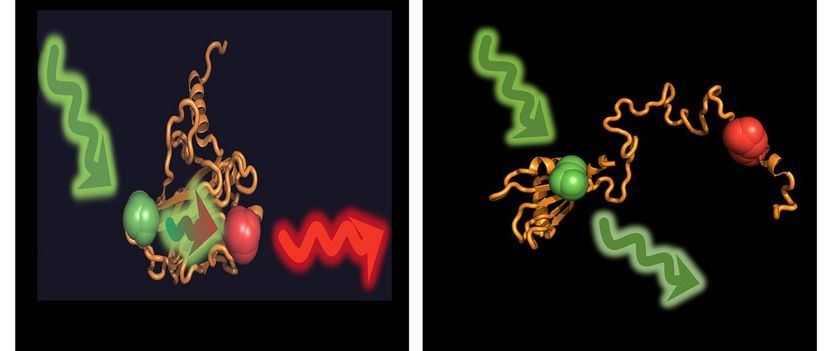
Ist das das Protein p53 gefaltet, kann der Donor eingestrahlte Energie auf den Akzeptor übertragen (links). Im aufgefalteten Zustand, der durch Chaperone induziert wird, sind beide zu weit voneinander entfernt.
G. Agam / LMU & V. Dahiya / TUM
Eine Krebstherapie ohne Nebenwirkungen, die gezielt nur Tumorzellen angreift – noch können Ärzte und Patienten davon nur träumen. Dabei hat die Natur ein solches gezieltes Anti-Tumor-Programm längst erfunden. Jede unserer Zellen ist damit ausgestattet: Werden gravierende Schäden im Erbgut erkannt, zerstört sich die Zelle selbst und verhindert so das Wachstum des Tumors. Ein Münchner Forschungsteam hat jetzt den komplexen Regelungsmechanismus, an dem verschiedene Proteine beteiligt sind, entschlüsselt.
„Dass es einen solchen Regelungsmechanismus gibt, und dass dabei das Tumorsuppressor-Protein p53 eine Schlüsselrolle spielt, weiß man schon lange. Nicht bekannt war bisher, welche Rolle molekulare Chaperone bei der Regulation der zellulären Maschinerie spielen“, erklärt Prof. Johannes Buchner, Inhaber des Lehrstuhls für Biotechnologie an der TUM.
Blick in die molekulare Maschine
Diese Chaperone – der Name stammt aus dem Englischen und bedeutet „Anstandsdame“ – sind Proteine, die darüber wachen, dass sich andere Proteine richtig falten und damit funktionstüchtig sind. Im Labor konnten die Forscherinnen und Forscher zeigen, dass zwei Gruppen dieser Chaperon-Proteine, Hsp70, Hsp40 und Hsp90, die Funktion des Tumorsuppressor-Proteins p53 steuern, indem sie seine dreidimensionale Struktur beeinflussen.
Im Reagenzglas beobachteten die Biochemiker was passiert, wenn sie zu einer Lösung, die p53 enthält, die Chaperone Hsp40 und Hsp70 zugaben. p53 verlor dadurch seine Fähigkeit an DNA zu binden. Damit kam auch seine biologische Aktivität zum Erliegen.
Ein Leuchten offenbart die Struktur
Doch was steckt dahinter? Um diese Frage beantworten zu können, markierten die Wissenschaftler p53 mit fluoreszierenden Farbstoffen. Damit konnten sie die Struktur einzelner p53 Moleküle vermessen. p53 alleine liegt gefaltet vor, unter dem Einfluss von Hsp40 und Hsp70 wird es unter Energieverbrauch vollständig entfaltet. Den gegenteiligen Effekt hat die Zugabe des Chaperons Hsp90: Es überführt das entfaltete p53 wieder in die aktive, gefaltete Form.
„Dieser enorme Einfluss der Chaperone hat uns überrascht“, erinnert sich Buchner. „Die Zelle verfügt hier über einen äußerst komplexen Regelmechanismus, mit dem die Chaperone das Tumorsuppressor-Protein in Schach halten.“ Solange die molekularen Anstandsdamen zur Verfügung stehen, ist p53 entfaltet und biologisch inaktiv. Gerät die Zelle aber unter Stress und die Chaperone müssen an anderen Orten für Ordnung sorgen, faltet sich p53, heftet sich an die DNA und löst, wenn nötig, den zellulären Selbstmord aus.
Laut Buchner, könnte das Verständnis dieses molekularen Zusammenspiels in Zukunft mit
dazu beitragen, die Rolle der Proteine besser zu verstehen und neue Angriffspunkte für die Krebstherapie zu finden.