Comment le microbiome intestinal réagit aux antibiotiques
Les antibiotiques affectent la composition et la dynamique du microbiome intestinal. Les traitements antibiotiques entraînent non seulement une perte de biodiversité des micro-organismes, mais favorisent aussi souvent la sélection de souches bactériennes résistantes. La façon dont le microbiome réagit à une antibiothérapie répétée n'est pas claire. Dans une étude préclinique, une équipe de recherche internationale dirigée par deux scientifiques du DZIF a utilisé des analyses du métagénome et des cultures pour identifier les mécanismes évolutifs qui contribuent à la résilience de la communauté microbienne après une administration répétée d'antibiotiques. L'étude vient d'être publiée dans la célèbre revue scientifique Cell Host & Microbe.
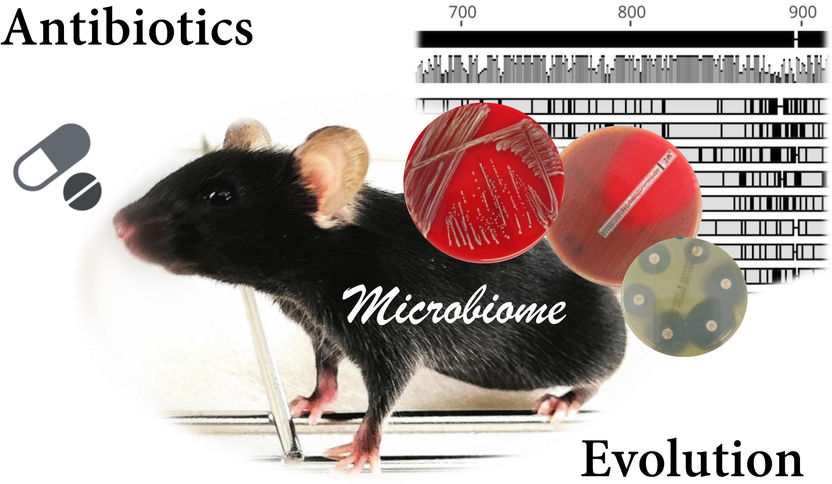
Illustration de la recherche sur le microbiome décrite : souris sans germe comme modèle animal, plaques de gélose avec des cultures de bactéries isolées de l'intestin, des bandes de test antibiotique et des plaquettes, et représentation d'une comparaison de séquences d'ADN.
Bärbel Stecher, Max von Pettenkofer Institute, LMU Munich
Le microbiome intestinal de chaque personne contient une communauté spécifique de micro-organismes qui reste normalement stable pendant des années. Toutefois, il peut être déséquilibré par des facteurs tels que des changements alimentaires, des infections ou des médicaments. Les antibiotiques, en particulier, ont une forte influence sur le microbiome. En réponse, les micro-organismes utilisent divers mécanismes de résistance, les populations bactériennes individuelles évoluant par sélection de variantes résistantes aux antibiotiques. Cependant, l'étendue et les mécanismes de ces processus, ainsi que leur impact sur l'écologie de la communauté microbienne, sont mal compris.
Bärbel Stecher et Alice McHardy, en collaboration avec une équipe de recherche internationale, ont étudié l'évolution des bactéries intestinales exposées à des perturbations répétées dues aux antibiotiques. Pour ce faire, ils ont utilisé un modèle de souris gnotobiotique, c'est-à-dire des souris exemptes de germes et colonisées de manière stable par un consortium connu de bactéries. Ce modèle permet d'étudier l'évolution des membres individuels de la communauté dans l'hôte naturel, dans des conditions bien définies et contrôlables. Les chercheurs ont ensuite analysé les effets de différentes classes d'antibiotiques sur le microbiome pendant une période de 80 jours. À l'aide d'analyses métagénomiques, ils ont suivi la sélection de mutations putatives favorisant la résistance aux antibiotiques dans les populations bactériennes et ont ensuite analysé les caractéristiques des clones bactériens évolués isolés des communautés.
"Nous avons pu observer comment des traitements antibiotiques répétés conduisent à la sélection de bactéries commensales résistantes aux antibiotiques, ce qui, après un certain temps, augmente la résistance de la communauté microbienne à certains antibiotiques tels que les tétracyclines. Outre l'adaptation du microbiome par l'évolution des micro-organismes individuels, nous avons également trouvé des preuves du développement de la résistance des bactéries individuelles par le ralentissement de la croissance cellulaire. Le microbiome s'adapte pour ainsi dire au traitement et est mieux à même d'y résister", explique Bärbel Stecher, coordinatrice du domaine de recherche sur les infections gastro-intestinales au Centre allemand de recherche sur les infections (DZIF) et professeur de microbiologie médicale et d'hygiène à l'Institut Max von Pettenkofer de l'Université Ludwig-Maximilians de Munich (LMU).
En outre, l'équipe de recherche a observé une induction de prophages déclenchée par le traitement avec certains antibiotiques. Dans ce processus, les bactériophages lysogènes - dont les génomes sont intégrés dans les génomes bactériens - sont activés, après quoi ils prolifèrent et lysent les cellules hôtes en libérant de nouvelles particules virales. "C'est un exemple de la façon dont les antibiotiques peuvent aussi affecter indirectement la survie des bactéries", explique le Dr Philipp Münch, premier auteur de l'étude.
Dans l'ensemble, l'étude montre une immense diversité dans la réponse du microbiome aux traitements antibiotiques. Cela inclut, par exemple, des effets écologiques tels que l'inhibition d'un micro-organisme par l'élimination d'une bactérie "partenaire" importante dans le réseau métabolique de l'écosystème intestinal.
"En raison de cette grande complexité des réponses directes et indirectes, il est difficile de prédire quelles espèces seront affectées par un traitement antibiotique, même dans des modèles animaux gnotobiotiques avec une communauté définie de micro-organismes", résume le professeur Alice McHardy, coordinatrice adjointe de la bioinformatique et de l'apprentissage automatique au DZIF et directrice du département de biologie informatique pour la recherche sur les infections au Centre Helmholtz pour la recherche sur les infections, une institution membre du DZIF.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.


































