Des chercheurs découvrent des "mini-usines" de pliage de protéines jusqu'alors inconnues
Pour que les protéines puissent remplir leurs multiples fonctions, elles doivent être pliées correctement. Une équipe de recherche de l'Université de Bâle a découvert une sorte d'"usine de pliage" dans laquelle les protéines sont pliées efficacement et sans erreur. L'absence de ces usines peut entraîner des maladies telles que le diabète ou des maladies neurodégénératives.
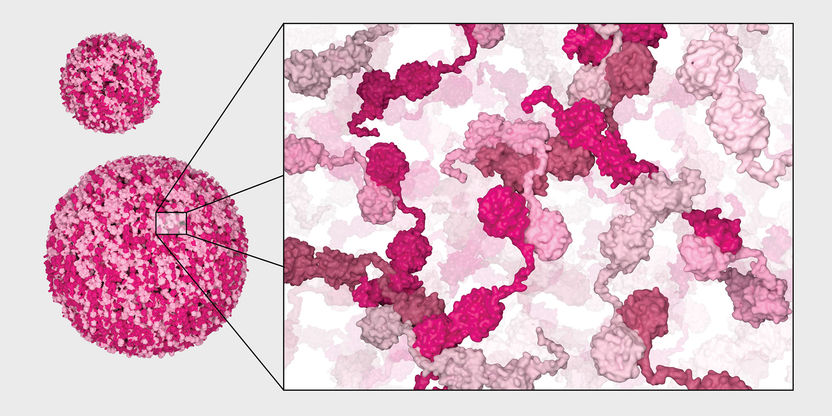
Modèle de formation des condensats chaperons.
Copyright: Biozentrum, Universität Basel
Les protéines sont les travailleurs de nos cellules : Elles transportent des substances, aident à la digestion et servent de matériaux de construction. Pour pouvoir remplir leurs multiples fonctions, elles doivent être placées dans la structure tridimensionnelle correcte, c'est-à-dire être pliées correctement. Tout un arsenal d'auxiliaires de pliage y veille : les chaperons. En collaboration avec le professeur Anne Spang, l'équipe du professeur Sebastian Hiller au Biozentrum de l'Université de Bâle a pu montrer pour la première fois que les chaperons se regroupent de manière autonome en "usines de pliage". C'est là que les protéines nouvellement fabriquées, qui n'étaient pas encore pliées au départ, prennent leur forme correcte.
Le point de départ de ce travail a été une observation clinique : dans plusieurs familles atteintes de maladies génétiques, dont la fibrose hépatique, le diabète et des troubles cognitifs, on a trouvé des mutations dans une chaperonne particulière, appelée PDIA6. "Cette observation a éveillé notre intérêt", explique Hiller. "Nous nous sommes demandé à quoi PDIA6 était réellement important et avons donc commencé à étudier sa fonction dans la cellule".
"Usine de pliage" dans la cellule
Le réticulum endoplasmique (RE) est la structure à l'intérieur des cellules dans laquelle les protéines sont pliées. C'est pourquoi on y trouve de nombreuses chaperons. "Traditionnellement, on pensait que les auxiliaires de repliement flottaient individuellement dans le RE", explique Anna Leder, première auteure du travail qui vient d'être publié dans "Nature Cell Biology". "Mais nous avons découvert qu'ils s'organisent de manière autonome et forment des structures en forme de gouttelettes, appelées condensats".
Ces condensats correspondent à une chaîne de montage sur laquelle les machines nécessaires au repliement des protéines sont disposées de manière optimale. Le PDIA6 veille à ce que plusieurs chaperons différents s'associent. Les molécules de PDIA6 interagissent entre elles et initient ainsi la formation d'un condensat, dans lequel de nombreuses autres chaperonnes se joignent. "La concentration d'auxiliaires de repliement est très élevée à cet endroit, de sorte que les protéines non repliées ou mal repliées y sont littéralement aspirées", explique Leder. "Ce n'est que lorsqu'elles sont correctement repliées qu'elles en sont libérées". Les condensats servent d'une part à contrôler la qualité et d'autre part à augmenter l'efficacité du repliement des protéines.
Sans condensats, pas d'insuline
Mais que se passe-t-il lorsque ces usines de pliage font défaut ? Les cellules sont alors massivement stressées, et dans le pire des cas, elles meurent, car il reste trop de protéines non pliées ou mal pliées. C'est précisément ce que les chercheurs ont pu observer dans d'autres expériences.
"Nous nous sommes penchés sur l'insuline, l'hormone qui régule la glycémie", explique Leder. "Le précurseur de la pro-insuline ne se plie correctement qu'à l'intérieur des condensats. Dans les cellules présentant des mutations dans le chaperon PDIA6, ces condensats ne se forment pas. Elles produisent donc moins d'insuline et en sécrètent également moins". Cela concorde avec les observations cliniques où les patients présentant des mutations de PDIA6 souffrent notamment de diabète.
Plus que la somme des éléments individuels
"Cette découverte est un véritable game changer", affirme Hiller. Jusqu'à présent, on ne connaissait absolument pas de tels condensats de chaperons. Ils ne sont pas seulement un effet secondaire fortuit, mais une unité organisationnelle importante. "Il est possible que nous devions repenser en profondeur le concept du RE, et peut-être aussi d'autres organelles cellulaires", déclare Hiller. "Il est probable que seule la présence de condensats permette d'expliquer et de comprendre réellement le fonctionnement du RE".
La connaissance de l'auto-organisation des chaperons est importante pour la poursuite de la recherche et, à long terme, pour la pratique médicale. De nombreuses maladies sont liées à des protéines mal repliées, comme les maladies neurodégénératives, le diabète, le cancer ou la fibrose kystique.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Allemand peut être trouvé ici.



































