Une enzyme neutralise les agents pathogènes en éliminant une toxine bactérienne
Des chercheurs du Leibniz-HKI découvrent une enzyme qui neutralise le facteur de virulence malleicyprol chez les bactéries pathogènes pour l'homme
Dans la revue Angewandte Chemie International Edition, une équipe de chercheurs du Leibniz-HKI décrit une nouvelle enzyme qui rend inoffensive la molécule hautement toxique qu'est le maléicyprol. Le maléicyprol est considéré comme un important facteur de virulence de la bactérie Burkholderia, qui est notamment à l'origine de la dangereuse maladie tropicale qu'est la mélioïdose. Cette découverte ouvre de nouvelles perspectives pour les stratégies de lutte contre les agents pathogènes résistants aux antibiotiques.
Burkholderia pseudomallei est considérée comme l'une des bactéries pathogènes les plus dangereuses des tropiques. La mélioïdose, causée par cette bactérie, est souvent grave et peut être fatale même avec un traitement. "Près de 170 000 nouvelles infections sont signalées chaque année dans le monde, et environ la moitié des personnes touchées en meurent", rapporte Jonas Fiedler. Le chercheur doctorant est le premier auteur de la publication et travaille dans l'équipe de Christian Hertweck, professeur de chimie des produits naturels à l'université Friedrich Schiller d'Iéna et responsable de l'étude à l'Institut Leibniz pour la recherche sur les produits naturels et la Biologie des infections (Leibniz-HKI).
Le pathogène est dangereux en raison de sa toxine, le malleicyprol, qui attaque les cellules et provoque la maladie. "Cela est dû à une petite structure chimique très réactive dans la molécule, l'anneau cyclopropanol", explique Fiedler.
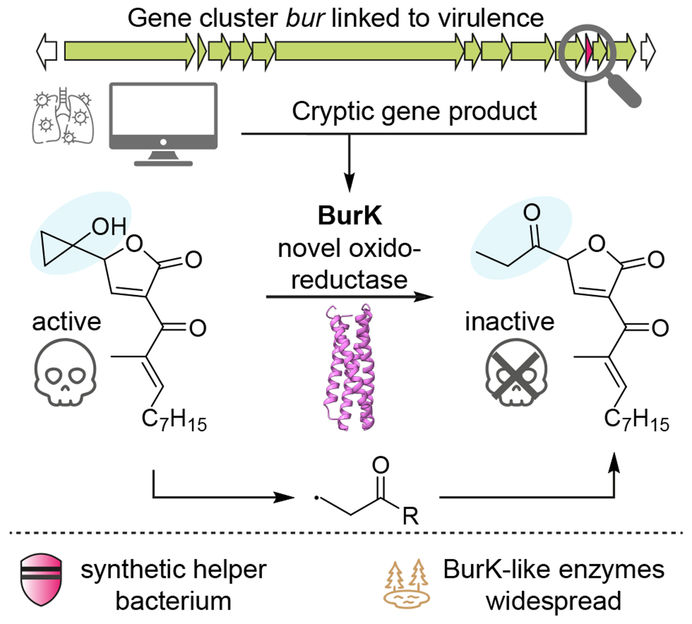
Représentation schématique du mécanisme d'action de l'enzyme BurK : l'enzyme clive une structure chimique hautement réactive de la toxine bactérienne malleicyprol, la rendant ainsi inoffensive. L'effet pathogène de Burkholderia est ainsi réduit.
Copyright: Jonas Fiedler, Leibniz-HKI
Un gène précédemment ignoré code pour une enzyme qui détruit la partie réactive de la molécule.
Bien que le malleicyprol soit un facteur important de la virulence des espèces de Burkholderia et que sa biosynthèse soit largement comprise, la fonction d'une enzyme restait incertaine : "Nous avons remarqué un petit gène qui code pour une protéine inconnue. Nous avons remarqué un petit gène qui code pour une protéine inconnue, mais nous n'avons pas pu attribuer au produit de ce gène une quelconque fonction dans la formation de la toxine. Nous avons voulu combler cette lacune et avons spécifiquement désactivé le gène pour comprendre son rôle", se souvient M. Fiedler.
Bien que la bactérie ait continué à produire le malleicyprol toxique, une variante inactive de la molécule a soudainement disparu. "Le gène doit donc coder pour une enzyme qui convertit la toxine en cette forme inoffensive", explique M. Fiedler.
Les chercheurs se sont alors intéressés à la manière dont l'enzyme - appelée BurK - modifie la structure moléculaire. Ce faisant, ils ont découvert un mécanisme remarquable : BurK utilise des composés contenant du fer pour générer des particules hautement réactives (radicaux). Celles-ci scindent l'anneau cyclopropanol, crucial pour la toxicité, et rendent ainsi le malleicyprol inoffensif. "Cela a été une véritable surprise", déclare M. Fiedler. "Aucune enzyme dans la nature n'était connue auparavant pour cliver spécifiquement un anneau de cyclopropanol. Il poursuit en expliquant : "Bien entendu, la bactérie ne désamorce pas la toxine pour protéger l'homme. Elle régule plutôt la quantité de toxine à l'aide de l'enzyme BurK".
Protection dans l'organisme modèle
Pour vérifier si BurK fonctionne également dans un système vivant, l'équipe de recherche a inséré le gène responsable dans la bactérie E. coli et l'a ensuite mise en contact avec des nématodes - de minuscules vers filiformes - auxquels on a également administré le malleicyprol toxique. "Les vers qui ont ingéré la toxine en même temps que les bactéries contenant BurK ont pu mieux survivre", rapporte Fiedler. Les vers témoins qui ont reçu la toxine et des bactéries sans l'enzyme sont morts parce que la toxine est restée efficace. Cela montre que BurK peut également neutraliser le malleicyprol dans les organismes vivants.
Les chercheurs ont découvert des gènes très similaires chez d'autres espèces bactériennes, ce qui suggère que les enzymes formées pourraient jouer un rôle important dans l'interaction avec d'autres organismes. Certains micro-organismes pourraient ainsi potentiellement se protéger contre les toxines d'autres bactéries ou même protéger leurs partenaires symbiotiques - tels que les nématodes - contre le malleicyprol nocif.
Des bactéries génétiquement modifiées contre les agents pathogènes ?
Même si la fonction exacte de ces enzymes dans la nature n'est pas encore claire, des applications pratiques pour l'homme sont envisageables : "La bactérie que nous avons générée pourrait être utilisée à des fins thérapeutiques pour neutraliser le malleicyprol. Toutefois, sa transférabilité aux infections humaines doit encore être étudiée de manière approfondie", déclare M. Fiedler. Une première application plus réaliste serait dans l'environnement, par exemple dans les régions où les bactéries Burkholderia sont naturellement présentes dans le sol : "Les sols affectés pourraient être décontaminés afin de réduire les effets toxiques", explique M. Fiedler. Les sols affectés pourraient être décontaminés afin de réduire les effets toxiques", explique M. Fiedler. "Cela devrait également faire l'objet de tests approfondis au préalable.
Quoi qu'il en soit, l'équipe de recherche montre que la nature dispose d'un incroyable répertoire d'outils, dont beaucoup sont encore cachés à l'homme. L'enzyme BurK en est un exemple remarquable. Christian Hertweck, chercheur principal, résume la situation : "Notre travail montre qu'il est possible de neutraliser spécifiquement le danger d'un pathogène sans avoir à le tuer directement. Cela ouvre de nouvelles perspectives pour le traitement futur des bactéries résistantes aux antibiotiques et pourrait faire partie de nouvelles thérapies à long terme."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.


































