Una enzima neutraliza patógenos mediante la degradación de una toxina bacteriana
Investigadores del Leibniz-HKI descubren una enzima que neutraliza el factor de virulencia malleicyprol en bacterias patógenas humanas
Un equipo de investigadores del Leibniz-HKI describe en la revista Angewandte Chemie International Edition una nueva enzima que convierte en inocua la molécula altamente tóxica malleicyprol. El malleicyprol se considera un importante factor de virulencia de la bacteria Burkholderia, causante, entre otras, de la peligrosa enfermedad tropical melioidosis. El descubrimiento abre nuevas vías para las estrategias contra los patógenos resistentes a los antibióticos.
La Burkholderia pseudomallei está considerada uno de los patógenos bacterianos más peligrosos de los trópicos. La enfermedad melioidosis, causada por esta bacteria, suele ser grave y puede ser mortal incluso con tratamiento. "Cada año se registran casi 170.000 nuevas infecciones en todo el mundo, y aproximadamente la mitad de los afectados mueren a causa de ella", informa Jonas Fiedler. El investigador doctoral es el primer autor de la publicación y trabaja en el equipo de Christian Hertweck, catedrático de Química de Productos Naturales de la Universidad Friedrich Schiller de Jena y responsable del estudio en el Instituto Leibniz de Investigación de Productos Naturales y Biología de las Infecciones (Leibniz-HKI).
El patógeno es peligroso por la toxina malleicyprol, que ataca las células y causa la enfermedad. "Esto se debe a una pequeña estructura química altamente reactiva en la molécula, el llamado anillo de ciclopropanol", explica Fiedler.
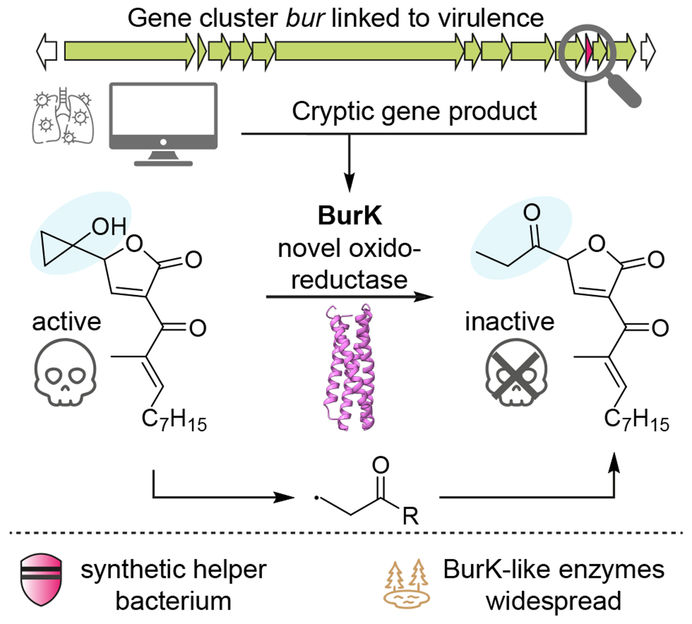
Representación esquemática del mecanismo de acción de la enzima BurK: La enzima escinde una estructura química altamente reactiva de la toxina bacteriana malleicyprol, convirtiéndola así en inofensiva. De este modo, se reduce el efecto patógeno de la Burkholderia.
Copyright: Jonas Fiedler, Leibniz-HKI
Un gen desconocido hasta ahora codifica una enzima que destruye la parte reactiva de la molécula.
Aunque el malleiciprol es un factor importante en la virulencia de las especies de Burkholderia y su biosíntesis se conocía en gran medida, la función de una enzima seguía sin estar clara: "Observamos un pequeño gen que codifica para una proteína desconocida. Sin embargo, no pudimos asignar a este producto génico ninguna función en la formación de toxinas. Queríamos colmar esta laguna y desactivamos específicamente el gen para comprender su función", recuerda Fiedler.
Aunque la bacteria seguía produciendo el malleiciprol tóxico, de repente faltaba una variante inactiva de la molécula. "Por tanto, el gen debe codificar una enzima que convierte la toxina en esta forma inocua", explica Fiedler.
Los investigadores se interesaron ahora por cómo exactamente la enzima -llamada BurK- cambia la estructura molecular. En el proceso, descubrieron un mecanismo extraordinario: BurK utiliza compuestos que contienen hierro para generar partículas altamente reactivas (radicales). Éstas dividen el anillo de ciclopropanol, crucial para la toxicidad, y hacen que el maleiciprol sea inofensivo. "Fue una auténtica sorpresa", afirma Fiedler. "Hasta ahora no se conocía ninguna enzima en la naturaleza que partiera específicamente un anillo de ciclopropanol". Y continúa explicando: "Por supuesto, la bacteria no desactiva la toxina para proteger a los humanos. Más bien, regula la cantidad de toxina con la ayuda de la enzima BurK".
Protección en el organismo modelo
Para comprobar si la BurK también funciona en un sistema vivo, el equipo de investigación insertó el gen responsable en la bacteria E. coli y luego la juntó con nematodos -pequeños gusanos de hilo- a los que también se administró el tóxico malleicyprol. "Los gusanos que ingirieron la toxina junto con bacterias que contenían BurK fueron capaces de sobrevivir mejor", informa Fiedler. Los gusanos de control que recibieron la toxina y bacterias sin la enzima murieron porque la toxina seguía siendo eficaz. Esto demostró que BurK también puede neutralizar el malleicyprol en organismos vivos.
Los investigadores descubrieron genes muy similares en otras especies bacterianas, lo que sugiere que las enzimas formadas podrían desempeñar un papel importante en la interacción con otros organismos. Así, algunos microorganismos podrían protegerse a sí mismos contra las toxinas de otras bacterias o incluso proteger a socios simbióticos -como los nematodos- del malleicyprol nocivo.
¿Bacterias modificadas genéticamente contra patógenos?
Aunque la función exacta de estas enzimas en la naturaleza aún no está clara, son concebibles aplicaciones prácticas para el ser humano: "La bacteria que hemos generado podría utilizarse terapéuticamente para neutralizar el malleicyprol. Sin embargo, todavía hay que investigar a fondo su transferibilidad a las infecciones humanas", afirma Fiedler. Una aplicación inicial más realista sería en el medio ambiente, por ejemplo en regiones donde la bacteria Burkholderia se da de forma natural en el suelo: "Los suelos afectados podrían descontaminarse para reducir sus efectos tóxicos", explica Fiedler. "Esto también habría que probarlo a fondo antes".
En cualquier caso, el equipo de investigación demuestra que la naturaleza dispone de un asombroso repertorio de herramientas, muchas de las cuales siguen ocultas a los humanos. La enzima BurK es un ejemplo notable de ello. El investigador principal, Christian Hertweck, lo resume así: "Nuestro trabajo demuestra que es posible neutralizar específicamente el peligro de un patógeno sin tener que matarlo directamente. Esto abre nuevas perspectivas para el futuro tratamiento de bacterias resistentes a los antibióticos y podría formar parte de terapias novedosas a largo plazo."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.