Se descubren nuevos objetivos contra el virus del moquillo canino
Determinada la estructura de la "proteína de acoplamiento" del virus del moquillo canino y representada a nivel molecular por primera vez - y esto también puede ayudar con el sarampión
El virus del moquillo canino, muy contagioso, es peligroso para los perros y los animales salvajes. Además, está estrechamente relacionado con el virus del sarampión, también muy contagioso. Investigadores de la Universidad de Berna y la Universidad de Ciencias Aplicadas de Zúrich han determinado por primera vez la estructura de la "proteína de acoplamiento" del virus del moquillo canino y la han representado a nivel molecular. Esto sienta las bases para desarrollar nuevas terapias que permitan un mejor tratamiento de las enfermedades inducidas por el VDC y otros virus afines, como el del sarampión.

Imagen simbólica
Computer-generated image
El virus del sarampión y el virus del moquillo canino (VDC) pertenecen al género Morbillivirus. Ambos patógenos infecciosos son virus ARN altamente contagiosos rodeados por una envoltura en la que sobresalen sus "proteínas de acoplamiento", similares a la proteína espiga de los coronavirus. Ambos virus inducen infecciones respiratorias, así como encefalitis mortales, aunque la alta incidencia de infecciones cerebrales es exclusiva del CDV. A pesar de la disponibilidad de una vacuna eficaz, el sarampión sigue matando a más de 100.000 personas cada año. El virus del moquillo canino, por su parte, causa grandes epidemias, especialmente en animales salvajes, incluidas especies en peligro de extinción como ciertas especies de tigres. También existe un alto riesgo de contagio a otras especies animales: en países con una cobertura vacunal subóptima, el virus puede afectar gravemente a los perros.
Ningún antivírico aprobado actualmente
En el caso del sarampión, los antivirales serían un complemento atractivo de las campañas de vacunación. Y para el CDV, los antivirales podrían apoyar la gestión de la enfermedad en especies amenazadas susceptibles que están en cautividad, por ejemplo, los pandas. Sin embargo, en la actualidad no se ha aprobado ningún fármaco antiviral contra el morbilivirus. Para desarrollar fármacos antivirales eficaces, es necesario comprender mejor la estructura de los virus del sarampión y del moquillo canino y los mecanismos que les permiten penetrar en las células humanas y animales. Investigadores dirigidos por Dimitrios Fotiadis, del Instituto de Bioquímica y Medicina Molecular (IBMM) de la Facultad de Medicina de la Universidad de Berna, y Philippe Plattet, de la División de Ciencias Neurológicas de la Facultad de Veterinaria de la Universidad de Berna, han logrado determinar por primera vez la estructura de la "proteína de acoplamiento" del virus del moquillo canino y representarla a nivel molecular. Estos hallazgos permiten desarrollar sustancias activas "a medida" contra la "proteína de acoplamiento" que impidan la entrada del virus en las células huésped. El estudio se publica en la revista Proceedings of the National Academy of Science USA.
Bloqueo selectivo de la "proteína de acoplamiento"
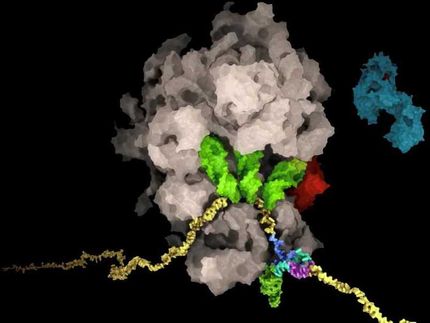
El mecanismo por el que los virus del sarampión y del moquillo canino penetran en las células se basa en dos proteínas de la envoltura vírica: una "proteína de acoplamiento" (también llamada proteína H) y una "proteína de fusión" (proteína F). Basándose en investigaciones anteriores, se supone que al interactuar con un receptor de la célula huésped, la proteína H transmite una señal que activará la proteína F. El resultado es la fusión del virus en la célula huésped. El resultado es la fusión de la envoltura vírica con la membrana de la célula huésped. En este proceso se forma el llamado poro de fusión, que permite la inyección del genoma vírico en la célula huésped. Ahora, el equipo dirigido por Dimitrios Fotiadis y Philippe Plattet, junto con investigadores de la Universidad de Ciencias Aplicadas de Zúrich (ZHAW), ha podido determinar por primera vez la estructura de esta proteína H mediante criomicroscopía electrónica (crioEM) y cartografiarla a nivel molecular. En la criomicroscopía electrónica, las muestras biológicas se analizan a temperaturas criogénicas (en torno a -180 °C) y se amplían 100.000 veces. Esto reveló que la proteína se caracteriza por tres dominios principales (cabeza, cuello y pedúnculo) que forman una "Y". "El hecho de que hayamos podido determinar la estructura representa un gran avance. Ahora nos permite comprender cómo se organizan espacialmente entre sí los distintos subdominios, y nos proporciona un valioso anteproyecto para desarrollar fármacos antivirales de nueva generación que bloqueen la "proteína de acoplamiento"", afirma Dimitrios Fotiadis.
Nuevos enfoques terapéuticos
"Bloquear simultáneamente el proceso de entrada celular del virus del moquillo y del sarampión con varias moléculas neutralizantes diferentes es una estrategia antivírica prometedora", explica Philippe Plattet. En la actualidad, los investigadores del consorcio Plattet y Fotiadis y de la Universidad de Marsella han identificado con éxito anticuerpos que neutralizan el VDC de forma muy eficaz. En futuras investigaciones, la plataforma crio-EM recientemente establecida en la Universidad de Berna proporcionará servicios útiles: los estudios estructurales del CDV y virus relacionados pueden ahora ampliarse y acelerarse, por ejemplo para determinar las estructuras de las proteínas H de los virus del sarampión y del moquillo cuando se unen a anticuerpos neutralizantes. "Gracias a las estructuras virales determinadas por crio-EM, podemos desarrollar y mejorar fármacos antivirales utilizando el llamado diseño de fármacos basado en estructuras", afirma Fotiadis.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
David Kalbermatter, Jean-Marc Jeckelmann, Marianne Wyss, Neeta Shrestha, Dimanthi Pliatsika, Rainer Riedl, Thomas Lemmin, Philippe Plattet und Dimitrios Fotiadis: Struktur und supramolekulare Organisation des Canine Distemper Virus Attachment Glycoproteins. Proc. Natl. Acad. Sci. USA, 30. Januar 2023