Cómo afecta la obesidad también a la próxima generación
Un estudio revela por qué los hijos de madres obesas son más propensos a desarrollar trastornos metabólicos
Los hijos de madres obesas tienen más riesgo de desarrollar trastornos metabólicos, aunque ellas mismas sigan una dieta sana. Un nuevo estudio de la Universidad de Bonn ofrece una explicación a este fenómeno. En los ratones obesos, determinadas células del hígado del embrión se reprograman durante el embarazo. Esto provoca cambios a largo plazo en el metabolismo de la descendencia. Los investigadores creen que estos hallazgos también podrían ser relevantes para los humanos. El estudio se publica ahora en la revista Nature.
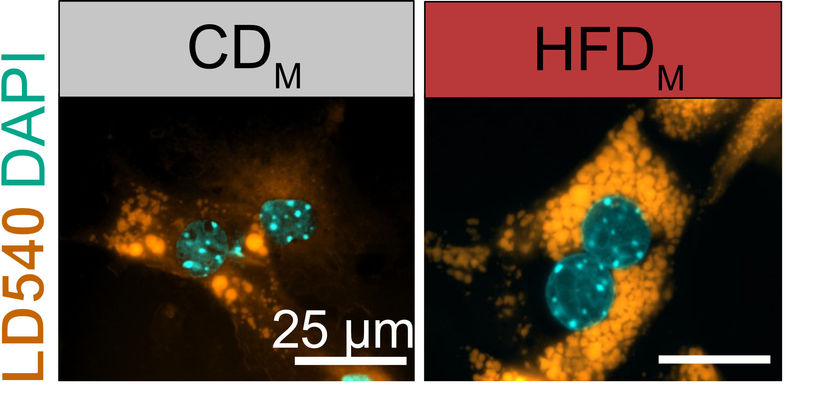
Las células hepáticas almacenan - más lípidos (amarillo, LD540) cuando se exponen a moléculas procedentes de células de Kupffer tomadas de la descendencia de ratones obesos (derecha, HFDM). La imagen de la izquierda muestra células hepáticas expuestas a factores procedentes de crías de madres con peso normal (CDM). Los núcleos celulares se muestran en cian.
© AG Mass/Uni Bonn
El equipo se centró en las llamadas células de Kupffer. Se trata de macrófagos, los llamados "grandes devoradores", que ayudan a proteger el organismo como parte del sistema inmunitario innato. Durante el desarrollo embrionario, migran al hígado, donde establecen su residencia permanente. Allí combaten los agentes patógenos y descomponen las células envejecidas o dañadas.
"Pero estas células de Kupffer también actúan como conductoras", explica la Prof. Dra. Elvira Mass, del Instituto LIMES de la Universidad de Bonn. "Dan instrucciones a las células hepáticas circundantes sobre lo que deben hacer. De este modo, contribuyen a que el hígado, como órgano metabólico central, realice correctamente sus múltiples tareas."
Cambiar la melodía: De Beethoven a Vivaldi
Sin embargo, parece que es esta función de conducción la que se ve alterada por la obesidad. Así lo sugieren los experimentos con ratones realizados por Mass en colaboración con otros grupos de investigación de la Universidad de Bonn. "Pudimos demostrar que las crías de madres obesas desarrollaban con frecuencia un hígado graso poco después de nacer", afirma el Dr. Hao Huang, del laboratorio de Mass. "Y esto ocurría incluso cuando las crías eran alimentadas con una dieta completamente normal".
La causa de este trastorno parece ser una especie de "reprogramación" de las células de Kupffer de las crías. Como resultado, envían señales moleculares que ordenan a las células hepáticas que absorban más grasa. En sentido figurado, ya no dirigen una sinfonía de Beethoven, sino una pieza de Vivaldi.
Este cambio parece producirse ya durante el desarrollo embrionario y es desencadenado por productos metabólicos de la madre. Éstos activan una especie de interruptor metabólico en las células de Kupffer y modifican a largo plazo el modo en que estas células dirigen las células hepáticas. "Este interruptor es un factor de transcripción", explica Mass. "Controla qué genes están activos en las células de Kupffer".
No hay hígado graso sin el interruptor molecular
Cuando los investigadores eliminaron genéticamente este interruptor en las células de Kupffer durante el embarazo, la descendencia no desarrolló hígado graso. Aún no está claro si este mecanismo podría combatirse con medicamentos. Los equipos tienen previsto investigarlo en estudios de seguimiento.
Si de ahí surgieran nuevos enfoques terapéuticos, sería una buena noticia. El comportamiento alterado de las células de Kupffer tiene probablemente muchas consecuencias negativas. La acumulación de grasa en el hígado, por ejemplo, va acompañada de fuertes respuestas inflamatorias. Éstas pueden hacer que un número creciente de células hepáticas mueran y sean sustituidas por tejido cicatricial. El resultado es la fibrosis, que deteriora gradualmente la función hepática. Al mismo tiempo, aumenta el riesgo de que las células hepáticas degeneren y se vuelvan cancerosas.
"Cada vez es más evidente que muchas enfermedades en humanos comienzan ya en una fase muy temprana del desarrollo", afirma Mass, que también es portavoz del área de investigación transdisciplinar "Vida y Salud" y miembro del consejo del Clúster de Excelencia "ImmunoSensation2" de la Universidad de Bonn. "Nuestro estudio es uno de los pocos que explican con detalle cómo puede producirse esta programación temprana".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Hao Huang, Nora R. Balzer, Lea Seep, Iva Splichalova, Nelli Blank-Stein, Maria Francesca Viola, Eliana Franco Taveras, Kerim Acil, Diana Fink, Franzisca Petrovic, ... Florent Ginhoux, Marc D. Beyer, Christoph Thiele, Felix Meissner, Jan Hasenauer, Dagmar Wachten, Elvira Mass; "Kupffer cell programming by maternal obesity triggers fatty liver disease"; Nature, 2025-6-18








































