Comment l'obésité affecte-t-elle aussi la prochaine génération ?
Une étude révèle pourquoi les enfants de mères obèses sont plus susceptibles de développer des troubles métaboliques
Les enfants nés de mères obèses courent un risque plus élevé de développer des troubles métaboliques, même si elles suivent elles-mêmes un régime alimentaire sain. Une nouvelle étude de l'Université de Bonn propose une explication à ce phénomène. Chez les souris obèses, certaines cellules du foie de l'embryon sont reprogrammées pendant la grossesse. Cela entraîne des changements à long terme dans le métabolisme de la progéniture. Les chercheurs estiment que ces résultats pourraient également s'appliquer à l'homme. L'étude vient d'être publiée dans la revue Nature.
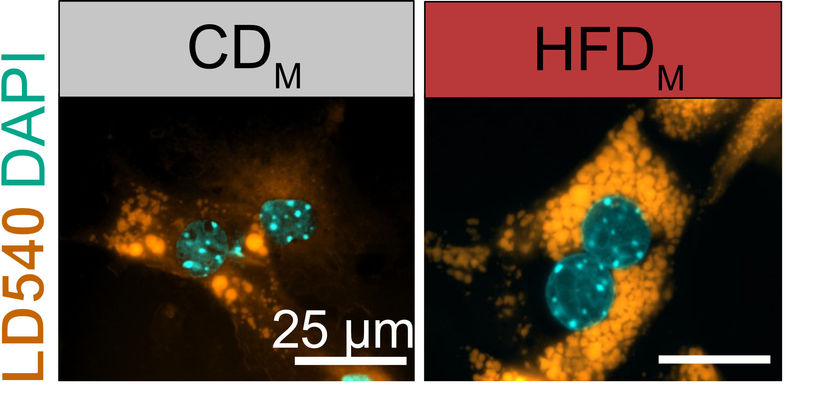
Les cellules hépatiques stockent - plus de lipides (jaune, LD540) lorsqu'elles sont exposées à des molécules provenant de cellules de Kupffer prélevées sur la progéniture de souris obèses (droite, HFDM). L'image de gauche montre des cellules hépatiques exposées à des facteurs provenant de la progéniture de mères de poids normal (CDM). Les noyaux cellulaires sont représentés en cyan.
© AG Mass/Uni Bonn
L'équipe s'est concentrée sur les cellules de Kupffer. Il s'agit de macrophages - les "gros mangeurs" - qui contribuent à protéger l'organisme dans le cadre du système immunitaire inné. Au cours du développement embryonnaire, elles migrent vers le foie, où elles s'installent définitivement. Elles y combattent les agents pathogènes et détruisent les cellules vieillissantes ou endommagées.
"Mais ces cellules de Kupffer agissent également comme des conducteurs", explique le professeur Elvira Mass, de l'institut LIMES de l'université de Bonn. "Elles indiquent aux cellules hépatiques environnantes ce qu'elles doivent faire. Elles contribuent ainsi à faire en sorte que le foie, en tant qu'organe métabolique central, accomplisse correctement ses nombreuses tâches."
Changer la musique : De Beethoven à Vivaldi
Or, il apparaît que c'est cette fonction conductrice qui est modifiée par l'obésité. C'est ce que suggèrent les expériences sur souris menées par Mass en collaboration avec d'autres groupes de recherche de l'université de Bonn. "Nous avons pu montrer que les enfants de mères obèses développaient souvent une stéatose hépatique peu après la naissance", explique le Dr Hao Huang du laboratoire de Mass. "Et ce, même lorsque les jeunes animaux étaient soumis à un régime alimentaire tout à fait normal.
La cause de ce trouble semble être une sorte de "reprogrammation" des cellules de Kupffer dans la progéniture. En conséquence, elles envoient des signaux moléculaires qui ordonnent aux cellules du foie d'absorber davantage de graisse. Au sens figuré, elles ne dirigent plus une symphonie de Beethoven mais un morceau de Vivaldi.
Ce changement semble se produire dès le développement embryonnaire et est déclenché par des produits métaboliques de la mère. Ceux-ci activent une sorte de commutateur métabolique dans les cellules de Kupffer et modifient la façon dont ces cellules dirigent les cellules du foie à long terme. "Ce commutateur est ce que l'on appelle un facteur de transcription", explique M. Mass. "Il contrôle les gènes actifs dans les cellules de Kupffer.
Pas de stéatose hépatique sans interrupteur moléculaire
Lorsque les chercheurs ont supprimé génétiquement cet interrupteur dans les cellules de Kupffer pendant la grossesse, les enfants n'ont pas développé de stéatose hépatique. On ne sait pas encore si ce mécanisme pourrait également être ciblé par des médicaments. Les équipes prévoient maintenant d'étudier cette question dans le cadre d'études de suivi.
Si de nouvelles approches thérapeutiques en découlent, ce serait une bonne nouvelle. L'altération du comportement des cellules de Kupffer a probablement de nombreuses conséquences négatives. L'accumulation de graisse dans le foie, par exemple, s'accompagne de fortes réponses inflammatoires. Celles-ci peuvent entraîner la mort d'un nombre croissant de cellules hépatiques et leur remplacement par du tissu cicatriciel. Il en résulte une fibrose qui altère progressivement la fonction hépatique. Parallèlement, le risque que les cellules hépatiques dégénèrent et deviennent cancéreuses augmente.
"Il devient de plus en plus évident que de nombreuses maladies humaines commencent déjà à un stade de développement très précoce", explique M. Mass, qui est également porte-parole du domaine de recherche transdisciplinaire "Life & Health" et membre du conseil d'administration du pôle d'excellence "ImmunoSensation2" à l'université de Bonn. "Notre étude est l'une des rares à expliquer en détail comment cette programmation précoce peut se produire.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Hao Huang, Nora R. Balzer, Lea Seep, Iva Splichalova, Nelli Blank-Stein, Maria Francesca Viola, Eliana Franco Taveras, Kerim Acil, Diana Fink, Franzisca Petrovic, ... Florent Ginhoux, Marc D. Beyer, Christoph Thiele, Felix Meissner, Jan Hasenauer, Dagmar Wachten, Elvira Mass; "Kupffer cell programming by maternal obesity triggers fatty liver disease"; Nature, 2025-6-18





































