Come l'obesità influisce anche sulla prossima generazione
Uno studio rivela perché i figli di madri obese hanno maggiori probabilità di sviluppare disturbi metabolici
Annunci
I bambini nati da madri obese hanno un rischio maggiore di sviluppare disturbi metabolici, anche se seguono una dieta sana. Un nuovo studio dell'Università di Bonn offre una spiegazione a questo fenomeno. Nei topi obesi, alcune cellule del fegato dell'embrione vengono riprogrammate durante la gravidanza. Questo porta a cambiamenti a lungo termine nel metabolismo della prole. I ricercatori ritengono che questi risultati possano essere rilevanti anche per gli esseri umani. Lo studio è stato pubblicato sulla rivista Nature.
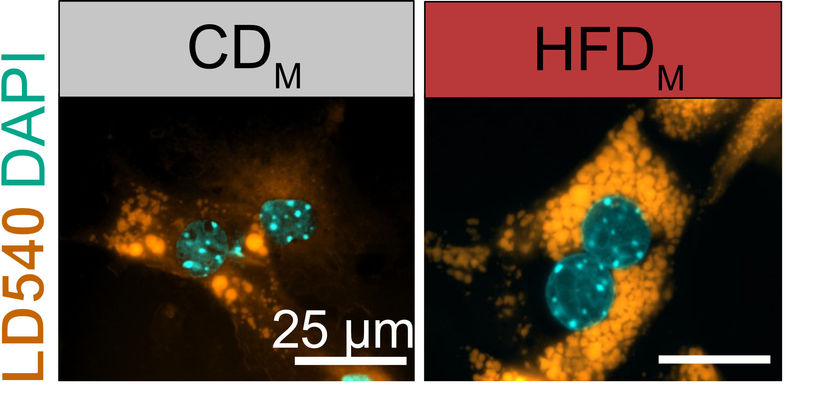
Le cellule epatiche immagazzinano - più lipidi (giallo, LD540) quando sono esposte a molecole provenienti da cellule di Kupffer prelevate dalla prole di topi obesi (destra, HFDM). L'immagine a sinistra mostra cellule epatiche esposte a fattori provenienti dalla prole di madri con peso normale (CDM). I nuclei delle cellule sono evidenziati in ciano.
© AG Mass/Uni Bonn
Il team si è concentrato sulle cosiddette cellule di Kupffer. Si tratta di macrofagi - i cosiddetti "grandi mangiatori" - che aiutano a proteggere il corpo come parte del sistema immunitario innato. Durante lo sviluppo embrionale, migrano nel fegato, dove risiedono stabilmente. Qui combattono gli agenti patogeni e distruggono le cellule invecchiate o danneggiate.
"Ma queste cellule di Kupffer agiscono anche come conduttori", spiega la Prof.ssa Elvira Mass dell'Istituto LIMES dell'Università di Bonn. "Danno istruzioni alle cellule epatiche circostanti su cosa fare. In questo modo, contribuiscono a garantire che il fegato, in quanto organo metabolico centrale, svolga correttamente i suoi numerosi compiti".
Cambiare la melodia: Da Beethoven a Vivaldi
Sembra tuttavia che sia proprio questa funzione di conduzione a essere modificata dall'obesità. È quanto suggeriscono gli esperimenti sui topi condotti da Mass in collaborazione con altri gruppi di ricerca dell'Università di Bonn. "Siamo riusciti a dimostrare che i figli di madri obese sviluppavano spesso un fegato grasso poco dopo la nascita", spiega il dottor Hao Huang del laboratorio di Mass. "E questo accadeva anche quando i giovani animali erano alimentati con una dieta del tutto normale".
La causa di questo disturbo sembra essere una sorta di "riprogrammazione" delle cellule Kupffer nella prole. Di conseguenza, esse inviano segnali molecolari che istruiscono le cellule epatiche ad assumere più grassi. In senso figurato, non dirigono più una sinfonia di Beethoven ma un brano di Vivaldi.
Questo cambiamento sembra avvenire già durante lo sviluppo embrionale ed è innescato da prodotti metabolici della madre. Questi attivano una sorta di interruttore metabolico nelle cellule di Kupffer e cambiano il modo in cui queste cellule dirigono le cellule epatiche a lungo termine. "Questo interruttore è un cosiddetto fattore di trascrizione", spiega Mass. "Controlla quali geni sono attivi nelle cellule di Kupffer".
Niente fegato grasso senza l'interruttore molecolare
Quando i ricercatori hanno rimosso geneticamente questo interruttore nelle cellule di Kupffer durante la gravidanza, la prole non ha sviluppato un fegato grasso. Non è ancora chiaro se questo meccanismo possa essere sfruttato anche con i farmaci. I team hanno ora in programma di indagare su questo aspetto in studi successivi.
Se dovessero emergere nuovi approcci terapeutici, sarebbe una buona notizia. Il comportamento alterato delle cellule di Kupffer ha probabilmente molte conseguenze negative. L'accumulo di grasso nel fegato, ad esempio, è accompagnato da forti risposte infiammatorie. Queste possono causare la morte di un numero crescente di cellule epatiche e la loro sostituzione con tessuto cicatriziale. Il risultato è la fibrosi, che compromette gradualmente la funzione epatica. Allo stesso tempo, aumenta il rischio che le cellule epatiche degenerino e diventino cancerose.
"È sempre più evidente che molte malattie nell'uomo iniziano già in una fase di sviluppo molto precoce", afferma Mass, che è anche portavoce dell'area di ricerca transdisciplinare "Life & Health" e membro del consiglio di amministrazione del cluster di eccellenza "ImmunoSensation2" dell'Università di Bonn. "Il nostro studio è uno dei pochi a spiegare nel dettaglio come può avvenire questa programmazione precoce".
Nota: questo articolo è stato tradotto utilizzando un sistema informatico senza intervento umano. LUMITOS offre queste traduzioni automatiche per presentare una gamma più ampia di notizie attuali. Poiché questo articolo è stato tradotto con traduzione automatica, è possibile che contenga errori di vocabolario, sintassi o grammatica. L'articolo originale in Inglese può essere trovato qui.
Pubblicazione originale
Hao Huang, Nora R. Balzer, Lea Seep, Iva Splichalova, Nelli Blank-Stein, Maria Francesca Viola, Eliana Franco Taveras, Kerim Acil, Diana Fink, Franzisca Petrovic, ... Florent Ginhoux, Marc D. Beyer, Christoph Thiele, Felix Meissner, Jan Hasenauer, Dagmar Wachten, Elvira Mass; "Kupffer cell programming by maternal obesity triggers fatty liver disease"; Nature, 2025-6-18






































