Mechanismus des bakteriellen Geruchssinns entdeckt
Anzeigen
Wissenschaftler des Moskauer Instituts für Physik und Technologie (MIPT) haben in Zusammenarbeit mit Kollegen vom Forschungszentrum Jülich, dem Institut de Biologie Structurale (IBS) und der European Synchrotron Radiation Facility (ESRF) in Grenoble eine Erklärung für einen universellen Mechanismus entwickelt, der Bakterien einen „Geruchssinn“ verleiht. Dazu wurde die Struktur des NarQ-Proteins aus dem Bakterium Escherichia coli (E. coli) entschlüsselt. Es zählt zu einer universellen Klasse sensorischer Histidinkinasen, die in Bakterien für die Übertragung von Signalen über ihre Umgebung verantwortlich sind. Der in der Fachzeitschrift Science veröffentlichte Artikel trägt zum Verständnis der Kommunikation von Bakterien untereinander bei und zeigt, wie sie Biofilme auf sterilen Oberflächen oder im menschlichen Körper bilden.
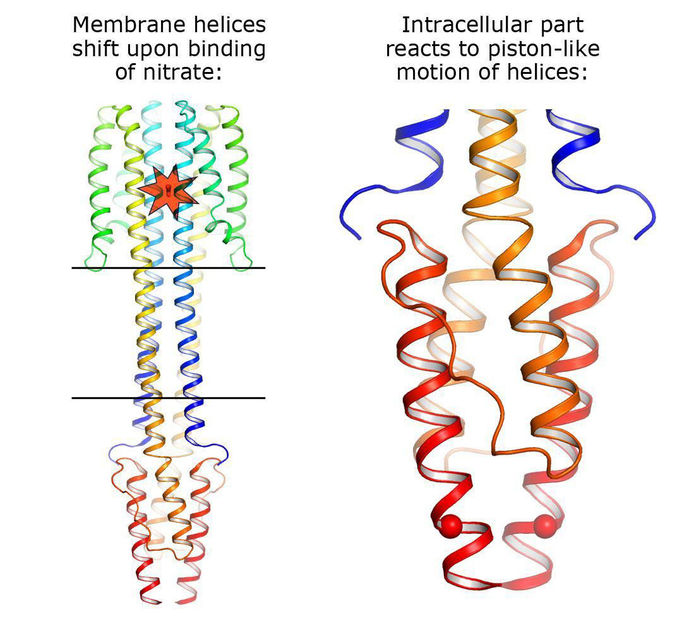
Mechanismus der Signalübertragung durch das NarQ-Protein
Copyright: Ivan Gushchin, Moscow Institute of Physics and Technology
Wirkstoffe, die diesen bakteriellen „Geruchssinn“ beeinflussen, könnten in Zukunft als Ersatz für konventionelle Antibiotika Verwendung finden. Diese Wirkstoffe würden die Bakterien nicht abtöten, sondern ihnen lediglich Signale zuführen, die sie für den menschlichen Körper harmlos machen würden. Theoretisch wäre in diesem Fall auch die Entwicklung von Resistenzen nicht möglich.
Alle Zellen sind von ihrer Umgebung durch eine dichte Membran isoliert, die kaum eine chemische Substanz durchdringen kann. Das ermöglicht es der Zelle, ihren inneren chemischen Zustand konstant und funktionsfähig zu halten. Jedoch schränkt die Membran auch den Informationsaustausch mit der Umgebung erheblich ein. Um herauszufinden, was außerhalb passiert, verwenden Zellen spezielle molekulare Maschinen – Proteine. Die Proteine, die zur Kommunikation mit der Umgebung dienen, „leben“ oft in der Membran selbst oder in ihrer Nähe und sind verantwortlich für die Übertragung von Signalen oder chemischen Substanzen in die Zelle oder aus ihr heraus.
Der häufigste Mechanismus, über den Bakterien ihre Umgebung sensorisch erfassen können, sind sogenannte Zweikomponentensysteme. Solche Systeme bestehen aus zwei Proteinen: einer Kinase, die das Signal von Außen aufnimmt und es in die Zelle weiterleitet, und einem Antwortregulator, der das Signal in der Zelle empfängt und Folgereaktionen auslöst.
Ein nützliches Verfahren zum Verständnis der Funktionsweise von Proteinen ist die Untersuchung ihrer Struktur mit atomischer Genauigkeit. Bislang wurden die meisten Proteinstrukturen (mehr als 100.000) mithilfe von Röntgenkristallografie erzielt. Dieses Verfahren erfordert die Aufzeichnung des Beugungsmusters von im Gitter angeordneten Proteinmolekülen. Jedoch offenbart dies nur die Struktur eines einzelnen Zustandes des Proteins, wie bei einem Foto. Durch Fotografieren des Anfangs- und Endzustandes eines Prozesses kann abgeleitet werden, wie genau das Protein funktioniert, wenn es zwischen diesen Zuständen umschaltet.
Membran-„Kolben“ treiben Zell-Geruchssinnn
Die Autoren der Studie konnten die Struktur zweier Zustände der NarQ-Kinase aus E. coli bestimmen. Diese Kinase „fühlt“ die Anwesenheit von Nitraten in der Umgebung und sendet ein entsprechendes Signal durch die Zellmembran. Wie sich herausstellte, ist der Sensor in beiden Zuständen ein Dimer, d. h. zwei Proteinmoleküle fangen gemeinsam das Nitrat ein. Der erste Zustand ist inaktiv – das Protein ist nicht an das Nitrat-Ion gebunden und überträgt kein Signal. Im Gegensatz dazu ist der zweite Zustand aktiv: In diesem Zustand überträgt die Kinase ein Signal in die Zelle hinein, um sie zu informieren, dass in der Umgebung Nitrate vorhanden sind.
Die Proteinstruktur im aktiven Zustand wurde beim verlässlichsten „Wildtyp“-Protein entschlüsselt, einem Protein ohne die künstlichen Mutationen, die von Wissenschaftlern oft genutzt werden, um die Stabilität von Proteinen zu erhöhen. Um die Struktur im inaktiven Zustand aufzuzeichnen, mutierten die Autoren den Abschnitt, an den das Nitrat andockt. Die Stabilität des Proteins wurde dadurch nicht beeinflusst; jedoch dockte das Nitrat nicht mehr daran an, sodass die Autoren die Möglichkeit hatten, eine Kinase im inaktiven Zustand zu beobachten.
Es stellte sich heraus, dass der Signal-Zustand sich nur äußerst geringfügig vom inaktiven Zustand unterscheidet: um 0,5–1 Ångström, was etwa einem Fünftel der Größe des gesamten Ions entspricht (1 Ångström entspricht 10-10 m). Jedoch bringt das Andocken dieses Ions an den Sensor starke Veränderungen im Protein mit sich. Die Helices verschiedener Monomere beginnen, sich wie Kolben in entgegengesetzten Richtungen zu bewegen. Diese „Kolben“ übertragen die kleine Veränderung um 0,5 bis 1 Ångström durch die Membran und ihre äußeren Enden verschieben sich um etwa 2,5 Ångström in entgegengesetzte Richtungen. In der Zelle, in der HAMP-Domäne, werden diese Verschiebungen in die entgegengesetzte Drehung der zwei Teile von NarQ übersetzt. Schließlich verändern sich die Positionen der Output-Helices um ganze 7 Ångström, womit die Signalübertragung abgeschlossen ist.
Neben den Strukturen, in denen die beiden Proteine ein symmetrisches Paar bilden, konnten die Wissenschaftler eine Struktur mit asymmetrischer Position der beiden Proteine produzieren. In diesem Zustand wird das Protein im Kristall anders angeordnet und ist stark gebogen. Jedoch bleibt der Effekt auf den den Antwortregulator beinahe unverändert. Die Vielseitigkeit der beobachteten Bewegung ermöglicht die Aussage, dass das Signalübertragungssystsem universell ist und dass die Sensoren anderer chemischer Verbindungen über den gleichen „Kolben-Verschiebe“-Mechanismus wirken könnten.
„Wie Signale durch die Zellmembran übertragen werden ist eine der wichtigsten Grundsatzfragen der modernen Biologie. In dieser Studie haben wir genau gezeigt, wie ein Signal (in diesem Fall das Anbinden des Nitrats) über hunderte von Ångström in die Zellen von Bakterien und Archaeen sowie von Pilzen und Pflanzen transportiert wird. Wir erwarten vom besseren Verständnis dieses Signalübertragungsmechanismus, dass wir herausfinden können, wie solche Zellen manipuliert werden können – vor allem, um die schädlichen Effekte pathogener Mikroorganismen abzuschwächen oder zu neutralisieren“ meint Ivan Gushchin, Leiter des Laboratory of Structural Analysis and Engineering of Membrane Systems am MIPT und zur Zeit der Studie ebenfalls Mitarbeiter des Institute of Complex Systems: Strukturbiochemie (ICS-6) am Forschungszentrum Jülich.
„Das Aufklären der strukturellen Grundlagen von Informationsverarbeitung in biologischen Systemen mit atomarer Genauigkeit ist ein faszinierendes Forschungsfeld“ sagt Dieter Willbold, Direktor des ICS-6. „Informationsgewinnung und -integration sowie anschließende Entscheidungsfindung sind absolut zentrale Prozesse für das Phänomen, das wir als Leben bezeichnen.“
Originalveröffentlichung
Ivan Gushchin, Igor Melnikov, Vitaly Polovinkin, Andrii Ishchenko, Anastasia Yuzhakova, Pavel Buslaev, Gleb Bourenkov, Sergei Grudinin, Ekaterina Round, Taras Balandin, Valentin Borshchevskiy, Dieter Willbold, Gordon Leonard, Georg Büldt, Alexander Popov, Valentin Gordeliy; "Mechanism of transmembrane signaling by sensor histidine kinases"; Science; published online May 18, 2017