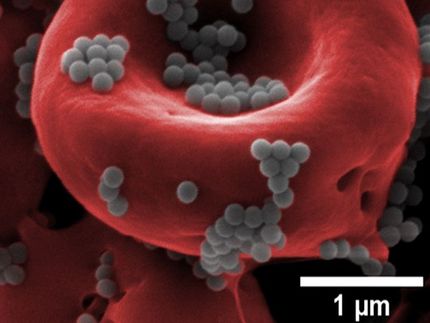
Thrombozyten-"Köder" überlisten sowohl Gerinnsel als auch Krebs
Potenzielle medikamentenfreie, reversible Therapie gegen Thrombozyten
Anzeigen
Herzerkrankungen, Schlaganfall, Sepsis und Krebs verursachen zusammen die meisten Todesfälle weltweit. Sie haben auch noch etwas anderes gemeinsam: Sie alle sind mit aktivierten Blutplättchen assoziiert, den Zellen, die in unseren Blutbahnen zirkulieren und normalerweise helfen, Blutgerinnsel zu bilden, um Blutungen zu stoppen und die Heilung zu fördern, wenn wir verletzt werden, können aber auch zu gefährlichen Blutgerinnseln, Tumoren und anderen Problemen beitragen. Mehrere Antiplättchen-Medikamente wurden entwickelt, um plättchenbezogene Erkrankungen zu bekämpfen, aber ihre Wirkung ist nicht leicht umkehrbar, und Patienten, die diese Medikamente einnehmen, laufen Gefahr, bei Verletzungen unkontrolliert zu bluten. Wenn sich diese Patienten einer Operation unterziehen müssen, müssen sie ihre Behandlung bis zu einer Woche vor dem Eingriff abbrechen, was ihr Risiko für die Bildung von Blutgerinnseln erhöht.
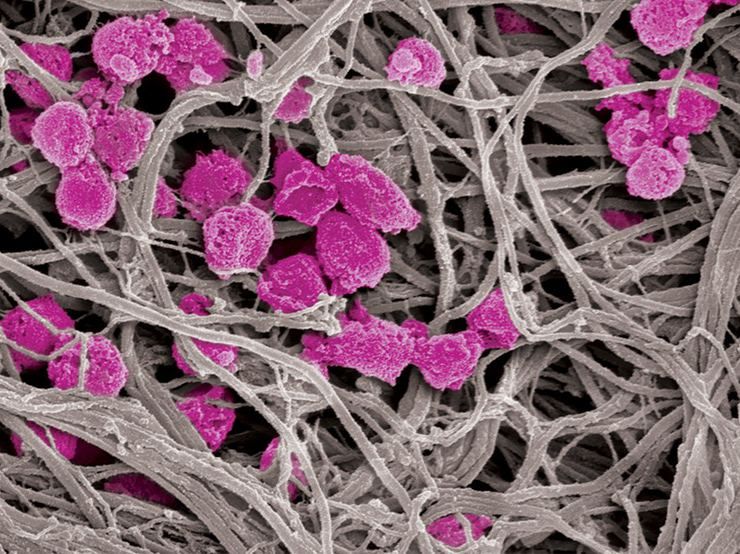
Thrombozytenköder (rosa) werden im Gegensatz zu normalen Thrombozyten nicht durch Kollagenfasern (grau) aktiviert, was sie zu einer attraktiven Option für die Antithrombose- und Krebsbehandlung macht.
Wyss Institute at Harvard University
Jetzt hat ein Forscherteam des Wyss Institute an der Harvard University und mehrerer kooperierender Institutionen eine medikamentenfreie, reversible Antiplättchentherapie entwickelt, bei der deaktivierte "Köder"-Plättchen zum Einsatz kommen, die das Risiko von Blutgerinnseln verringern und möglicherweise auch Krebsmetastasen verhindern könnten.
"Die Reversibilität und der sofortige Wirkungseintritt sind wesentliche Vorteile unserer Thrombozytenköder, und wir sehen sie als nützlich in krankenhausbasierten Situationen an, wie z.B. die Verhinderung der Gerinnung bei Hochrisikopatienten kurz vor der Operation oder wenn sie neben einer Chemotherapie gegeben werden, um die Ausbreitung bestehender Tumore zu verhindern", sagte Erstautorin Anne-Laure Papa, Ph.D..., der als Postdoc am Wyss Institute mit dem Gründungsdirektor des Instituts, Dr. Donald Ingber, Ph.D., als die Forschung durchgeführt wurde, zusammenarbeitete und heute Assistant Professor an der George Washington University ist. Ingber ist auch der Judah Folkman Professor für Gefäßbiologie an der Harvard Medical School und dem Vascular Biology Program am Boston Children's Hospital sowie Professor für Bioengineering an der Harvard's School of Engineering and Applied Sciences.
Gerinnsel auflösen
Die Köder sind menschliche Blutplättchen, deren äußere Lipidmembran und Innereien im Labor durch Zentrifugation und Behandlung mit einem Waschmittel entfernt wurden. Da sie im Wesentlichen leer sind, sind die Köder etwa ein Drittel so groß wie normale Blutplättchen, aber sie halten den Großteil der Kleberproteine auf ihren Oberflächen zurück. Die Köder können diese Oberflächenmoleküle noch nutzen, um sich an andere Zellen zu binden, die natürlich im Blutkreislauf vorkommen, aber sie können den Gerinnungsprozess nicht aktivieren.
Als die Köder in einen mikrofluidischen, Blutgefäß-ähnlichen Kanal perfundiert und plättchenstimulierenden Chemikalien ausgesetzt wurden, zeigten sie kein normales Gerinnungsverhalten. Und als die Forscher dem normalen menschlichen Blut (ein Köder pro fünf Blutplättchen) im Kanal Köder hinzufügten, stellten sie fest, dass die Fähigkeit der normalen Blutplättchen, sich an die Wände des Kanals zu binden, reduziert war.
"Die Köder sind im Gegensatz zu normalen intakten Blutplättchen nicht in der Lage, sich an die Gefäßwand zu binden und behindern wahrscheinlich auch die Fähigkeit der normalen Blutplättchen, sich zu binden. Eine Möglichkeit, sich das vorzustellen, wäre, dass die Köder schnell bewegte Schlittschuhläufer sind, die entlang der Wand einer Eisbahn laufen, und ihre hohe Geschwindigkeit verhindert, dass andere Schlittschuhläufer an die Wand gelangen, wodurch sie davon abgehalten werden, langsamer zu werden und sich daran zu klammern." erklärte Papa.
Wichtig ist, dass die Wissenschaftler in der Lage waren, die Hemmung der normalen Thrombozytenaktivität durch die Zugabe von frischen Thrombozyten in den Kanälen schnell umzukehren. Die intravenöse Verabreichung von Blutplättchen an Patienten ist bereits ein gängiges Verfahren in Krankenhäusern, so dass ein Patient mit Köderplättchen, der aufgrund einer Verletzung oder Operation schnell wieder in der Lage sein musste, Blutgerinnsel zu bilden, innerhalb kurzer Zeit leicht behandelt werden kann. Die Köder könnten auch aus Blutplättchen hergestellt werden, die vom gleichen Patienten entfernt wurden, was eine Form der personalisierten Zelltherapie bietet, die keine Immunreaktion auslösen würde.
Die Forscher testeten ihre Köder dann an Kaninchen und fanden heraus, dass das gleiche Verhältnis von Ködern zu normalen Blutplättchen in ihrem Blut sie daran hinderte, nach einer Blutgefäßverletzung Blutgerinnsel zu entwickeln. Kaninchen und Menschen haben ähnliche Blutplättchenzahlen und Blutplättchengrößen, so dass es wahrscheinlich ist, dass sie bei menschlichen Patienten die gleiche Wirkung haben würden.
Tumore vereiteln
Neben der Bindung aneinander und an die Wände der Blutgefäße binden sich die Blutplättchen an Krebszellen, schützen sie vor dem Immunsystem des Körpers und helfen ihnen so, an entfernten Stellen neue metastatische Tumore zu bilden. Als das Team normale Blutplättchen und menschliche Brustkrebszellen in ihre mikrofluidischen Kanäle perfundierte, hafteten die Krebszellen an und begannen, in die Wände des Kanals einzudringen, ähnlich wie bei der Bildung neuer Tumore. Ermutigend ist, dass das Hinzufügen von Ködern zusammen mit normalen Blutplättchen fast vollständig verhindert hat, dass die Blutplättchen den Krebszellen helfen, in die Kanalwand einzudringen, was darauf hindeutet, dass sie die Bildung neuer Tumore verhindern könnten.
Um dieses Potenzial zu bestätigen, injizierten die Forscher Mäuse entweder mit menschlichen Blutplättchen oder einer Kombination aus Blutplättchen und Ködern und dann mit menschlichen Brustkrebszellen. Das Team fand heraus, dass die Mäuse, die die Blutplättchen und Köder erhielten, deutlich kleinere und weniger metastatische Tumore entwickelten als diejenigen, die normale Blutplättchen erhielten. Obwohl sie noch nicht am Menschen getestet wurden, ist es möglich, dass diese Köder eines Tages während der Chemotherapie in Patienten infundiert werden, um die Ausbreitung bestehender Tumore zu verhindern, oder während Krebsoperationen injiziert werden, um freigesetzte Tumorzellen davon abzuhalten, neue Tumore an anderer Stelle im Körper zu bilden.
Papas Labor arbeitet weiterhin an dieser Technologie, um sicherzustellen, dass die Köder im Blutkreislauf für eine verbesserte Wirksamkeit länger halten können, und untersucht, ob sie mit Medikamenten beladen werden können, um Therapien direkt an die Stellen von Blutgerinnseln und Tumoren zu bringen oder möglicherweise sogar zirkulierende Tumorzellen im Blutkreislauf abzutöten.
"In dieser Studie konnten wir eine dominant-negative Zelltherapie entwickeln, um eine Thrombozytenaktivierung induzierte Gerinnung und metastatische Kaskaden zu verhindern", sagte Ingber. "Es ist ein weiteres Beispiel dafür, dass scheinbar unzusammenhängende Krankheiten oft gemeinsame Faktoren haben, wie Entzündungen, Stress oder in diesem Fall aktivierte Blutplättchen, und dass wir neue Therapien für mehrere Krankheiten entwickeln können, indem wir auf einen dieser Schlüsselfaktoren zielen."