Nervenzellen im Schilderwald
Anzeigen
Damit wir uns bewegen können, müssen sich Nervenzellen mit Muskel- und anderen Nervenzellen verbinden. Auf ihrem Weg werden die auswachsenden Nervenzellfortsätze von "Verbotsschildern" auf der Oberfläche anderer Zellen geleitet. Zellkulturstudien ließen vermuten, dass Protein-schneidende Enzyme (Proteasen) diese Schilder sofort entfernen, wenn sie von den wachsenden Fortsätzen erkannt wurden. Die "Erkennungsbindung" zwischen Zellfortsatz und Schild wird dadurch schneller getrennt und die Zellfortsätze werden schneller in die neue Richtung verwiesen. Wissenschaftler des Max-Planck-Instituts für Neurobiologie in Martinsried bei München und des Institut de Recherches Cliniques de Montréal zeigen nun im Tiermodell, dass Proteasen tatsächlich die Navigation von Nervenzellfortsätzen regulieren. Sie tun dies jedoch, indem sie die Zahl der vorhandenen Schilder regulieren. Ohne Proteasen werden die Schilder verdeckt und Zellfortsätze werden fehlgeleitet. Die Ergebnisse helfen, die Vernetzung der Zellen während der Entwicklung zu verstehen und könnten auch für das Verständnis neurodegenerativer Erkrankungen wie der Amyotrophen Lateralsklerose (ALS) interessant sein.
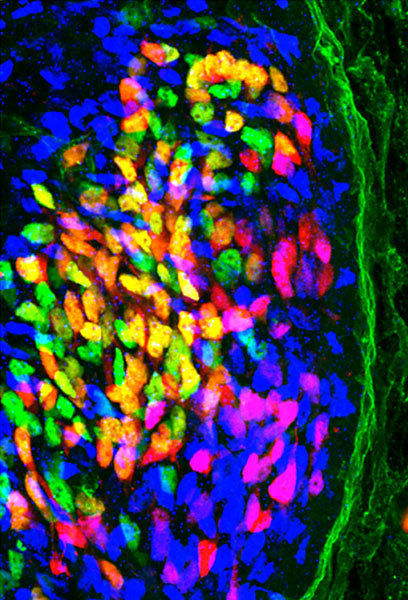
Während der Entwicklung schicken Nervenzellen (hier in blau, grün und gelb) ihre Axone zu bestimmten Beinmuskeln. Treffen die EphA4-Rezeptoren der auswachsenden Nervenzellen nicht mehr auf frei zugängliche Ephrine, finden die Fortsätze vieler Nervenzellen (violett) nicht mehr zu ihren Partnerzellen.
© MPI für Neurobiologie/ Gatto
Das menschliche Gehirn besteht aus rund 100 Milliarden Nervenzellen. Jede einzelne dieser Zellen vernetzt sich im Laufe der Embryonalentwicklung über einen langen Fortsatz, das Axon, mit anderen Zellen. Zum Teil muss ein Axon dabei weite Strecken durch den Körper navigieren, damit zum Beispiel eine Verbindung zwischen Rückenmark und Bein entsteht. Erst so wird es uns möglich, fein justierte Bewegungsabläufe auszuführen wie beispielsweise über eine Mauer zu balancieren.
Es ist somit essenziell, dass sich die richtigen Nervenzellen miteinander verbinden. Doch wie findet ein Axon seinen Weg und die entsprechenden Partnerzellen unter Milliarden anderer Zellen? "Wir kennen heute ein paar Dutzend Lenkungsmoleküle und ihre Rezeptoren, die zusammen Axonen bei der Orientierung helfen", so Rüdiger Klein, Direktor am Max-Planck-Institut für Neurobiologie. Diese wenigen Rezeptor-Lenkungsmolekül-Paare steuern jedoch sehr viele Navigationsentscheidungen. "Es muss daher Mechanismen geben, die die Effekte dieser Proteinpaare verstärken und abwandeln", überlegt Klein.
Rüdiger Klein und sein Team erforschen die Wegfindung von Nervenzellen während der Entwicklung. Im Fokus der Wissenschaftler stehen dabei die "Verbotsschilder", die Ephrin Lenkungsmoleküle und ihre Eph-Rezeptoren. Ephrine und Eph-Rezeptoren befinden sich auf fast allen Zelloberflächen: auf Axonen ebenso wie auf Zellen des umgebenden Gewebes. Sie helfen den wachsenden Axonen, ihren Weg und ihre Partnerzelle zu finden.
Wenn ein Axon durch den Körper wandert, dockt es immer wieder über das Ephrin/Eph-System an andere Zellen an. Dadurch werden zelluläre Prozesse in einer oder beiden Zellen ausgelöst, die schließlich zum Trennen der Verbindung und Abstoßen der Zellen voneinander führen. So wird das Axon in die richtige Richtung gelenkt. Eine gängige Theorie besagt, dass diese Zellabstoßung durch Proteasen beschleunigt wird. Proteasen sind Enzyme, die Eph-Rezeptoren oder Ephrine abschneiden, und so die Verbindung zwischen den Zellen lösen können. "Proteasen könnten so zu Veränderungen in den Lenkungsvorgängen beitragen – aber bewiesen ist das noch nicht", so Rüdiger Klein.
Nicht schneller, aber besser
Um die Wissenslücke zu schließen, untersuchten die Neurobiologen in Mäusen den Einfluss von Proteasen auf die Geschwindigkeit der Zellabstoßung, die durch EphA4-Rezeptoren und ihre Ephrine gelenkt wird. Tatsächlich schienen die Versuche in Zellkultur die Theorie zunächst zu bestätigen. "Im lebenden Organismus haben wir dagegen etwas ganz anderes gefunden", berichtet Rüdiger Klein. Anders als erwartet verlief die Zellabstoßung in Tieren, deren EphA4-Rezeptoren auf den Axonen nicht von Proteasen geschnitten werden konnten, mit unveränderter Präzision. Konnten die EphA4-Rezeptoren jedoch weder auf den Axonen noch im Zielgewebe von Proteasen geschnitten werden, dann wuchsen viele Axone in die falsche Richtung. Durch das fehlende Zerschneiden reicherten sich immer mehr funktionsfähige EphA4-Rezeptoren im umgebenden Gewebe auf den Zelloberflächen an. Diese Rezeptoren binden an die auf der gleichen Zelloberfläche vorhandenen Ephrine. So werden die Ephrine "verdeckt" – für die Eph-Rezeptoren eines heranwachsenden Axons blieben keine Verbotsschilder mehr übrig. Als Konsequenz wurde das Axon nicht mehr abgestoßen und fand nicht mehr in sein Zielgebiet.
Die Ergebnisse zeigen, dass das Spalten der Eph-Rezeptoren durch Proteasen nicht, wie erwartet, die Abstoßungsreaktion beschleunigt. Es reguliert vielmehr die Zahl funktionierender Rezeptoren und indirekt die Zahl frei zugänglicher Ephrine in den Zellen, die als Navigationshilfen dienen. Ist das Gleichgewicht gestört, werden auswachsende Axone fehlgeleitet.
Dies ist eine wichtige Erkenntnis, da EphA4-Rezeptoren essenzielle Funktionen während der Entwicklung von neuronalen Netzwerken im Gehirn und Rückenmark haben. Auch werden sie mit neurodegenerativen Erkrankungen wie der Amyotrophen Lateralsklerose (ALS) in Zusammenhang gebracht: Fehlt der EphA4-Rezeptor, bricht die Krankheit in verschiedenen Tiermodellen später aus und entwickelt sich langsamer. "Es könnte sein, dass durch die regulierende Wirkung von Proteasen die Zahl der EphA4-Rezeptoren auf ein niedriges Maß eingestellt werden wird", überlegt Rüdiger Klein. "Das könnte eine Möglichkeit sein, den Krankheitsverlauf der ALS positiv zu beeinflussen."
























































