Gedrängel in der Zelle
Kostenfaktor bei der Proteinsynthese
Sollen Zellen wachsen und sich erfolgreich vermehren, müssen sie große Mengen an Proteinen bilden. Diese werden von speziellen Zellmaschinen, den Ribosomen, hergestellt. Will man das Wachstum beschleunigen, braucht es also einer Vielzahl solcher Ribosomen. Die sind aber für die Zelle aufwendig herzustellen und müssen effizient genutzt werden. In einer neuen Studie untersuchte ein Forscherteam des MPI für Kolloid- und Grenzflächenforschung und von Universitäten in Kanada, Dänemark und den USA anhand des Bakteriums Escherichia coli wie dieses Problem gelöst wird. Die Wissenschaftler fanden heraus, dass die ökonomische Strategie bei der Nutzung der Ribosomen nahezu optimal ist. Die Strategie koppelt die Anzahl der Ribosomen in der Zelle mit deren Arbeitsgeschwindigkeit. Je mehr Ribosomen es in einer Zelle gibt, desto schneller arbeiten diese. Zusätzlich identifizierte die Studie die langsame Diffusion in den Zellen als eigentliche Limitierung der Geschwindigkeit.
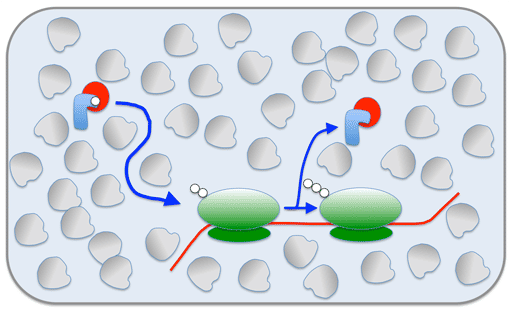
Das Innere einer Zelle ist dicht gepackt: Ternäre Komplexe (rot-blau) müssen sich im Gewimmel orientieren um Aminosäuren (weiß) bei den Ribosomen (grün) abzuliefern. Der zufällige Lauf durch die Menge begrenzt dabei die Geschwindigkeit mit der die Ribosomen Proteine synthetisieren können.
MPI für Kolloid- und Grenzflächenforschung
Will eine Firma expandieren, so investiert sie typischerweise in Maschinen um noch größere Mengen eines Produktes herstellen und verkaufen zu können. So ähnlich kann man sich das auch für die Zellen unseres Körpers vorstellen, wenn sie wachsen und sich vermehren wollen. Sie stecken ihre Ressourcen in Zellmaschinen wie beispielsweise Ribosomen. Auf diese Weise werden Proteine erzeugt und es entsteht am Ende eine neue Zelle. Bis dahin müssen viele ökonomische Entscheidungen getroffen werden, so z.B. ob es besser ist, nur wenige Ribosomen zu haben, die sehr schnell arbeiten, oder doch lieber viele Ribosomen, die dafür aber langsamer sind. Die Zelle kann entweder sämtliche Kräfte in die Ausbildung von vielen Ribosomen stecken oder weniger Ribosomen dafür mit höherer Geschwindigkeit arbeiten lassen.
In der jetzt veröffentlichten Studie haben Wissenschaftler herausgefunden welche Strategie wann eingesetzt wird. Sie verglichen dafür ein theoretisches Modell für eine proteomische Zuteilung von Ressourcen mit experimentellen Daten für ein Escherichia coli Bakterium. Das Bakterium wurde unterschiedlichen Nährstoffquellen ausgesetzt, was sich in unterschiedlichen Wachstumsraten niederschlug. Dabei konnte beobachtet werden, dass das Bakterium eine Kombination von zwei verschiedenen Strategien verfolgt. Soll das Zellwachstum beschleunigt werden, wird sowohl die Anzahl der Ribosomen als auch deren Arbeitsgeschwindigkeit erhöht. Handelt es sich dabei um die wirkungsvollste Investmentstrategie einer Zelle? „Nach unserem Modell nutzt die Zelle ihre Ressourcen nicht ganz optimal, aber fast. Eine Verbesserung dieser einfachen Methode ist sicherlich mit zusätzlichem Aufwand für die Zelle verbunden und damit kostspielig“ sagt Stefan Klumpp, Gruppenleiter am MPI für Kolloid- und Grenzflächenforschung und leitender Wissenschaftler der Studie.
Aber warum ist es eigentlich so schwierig, Ribosomen schneller und damit effektiver zu machen? Proteine sind Ketten aus verschiedenen Aminosäuren, die durch Ribosomen in die richtige Reihenfolge gebracht werden. Dafür müssen die Aminosäuren durch einen „Lieferservice“, so genannte ternäre Komplexe, an die Ribosomen übergeben werden. Sollen die Ribosomen schneller arbeiten, muss natürlich auch die Lieferung schneller von statten gehen. Doch hier setzt die Physik eindeutige Grenzen: Das Innere einer Zelle ist so dicht mit Proteinen und anderen Molekülen gepackt, dass sich die großen ternären Komplexe nur langsam durch das Gewirr hindurchdrängen können. Es gibt nur eine Chance, das Ziel schneller zu erreichen: Es werden viele gleichzeitig ins Rennen geschickt. Einer dieser „Lieferwagen“ erreicht dann höchstwahrscheinlich rechtzeitig das Ribosom. Aber je mehr ternäre Komplexe gebildet werden, desto mehr werden auch wieder Ribosomen gebraucht, die diese erzeugen.
Bakterielle Ribosomen sind das Ziel vieler Antibiotika. Die vorgelegte Untersuchung liefert jetzt ein theoretisches Fundament für das Verständnis der Zellreaktionen auf Antibiotika. So versuchen Zellen normalerweise die durch Antibiotika reduzierte Funktionalität von Ribosomen zu kompensieren, indem sie noch mehr davon herstellen. Ähnliche ökonomische Zwänge werden auch bei allen anderen Zellarten erwartet, so lange diese schnell wachsen und sich vermehren. Das Ergebnis dieser Untersuchungen könnte in Zukunft auch auf höher organisierte Organismen angewendet werden wie z.B. Krebszellen.





















































