Genschere repariert defekte Immunzellen
Mithilfe CRISPR-Cas9 lassen sich erbliche Gendefekte reparieren, die zu einer überschießenden Immunantwort führen, die tödlich enden kann
Anzeigen
Die familiäre hämophagozytische Lymphohistiozytose (FHL) ist eine seltene Erkrankung des Immunsystems. Betroffen sind meist Säuglinge und Kleinkinder im Alter von bis zu 18 Monaten. Sie erkranken schwer und die Sterblichkeit ist hoch. Ursache sind verschiedene Genmutationen, die eine normale Funktion der zytotoxischen T-Zellen verhindern. Dabei handelt es sich um eine Gruppe von Abwehrzellen, die von Viren befallene oder auf andere Weise veränderte Körperzellen töten. Infiziert sich ein betroffenes Kind – etwa dem Epstein-Barr-Virus (EBV), aber auch mit anderen Viren – können die zytotoxischen T-Zellen die befallenen Zellen nicht beseitigen. Stattdessen läuft die Immunantwort aus dem Ruder. Es kommt zu einem Zytokinsturm und einer überschießenden Entzündungsreaktion, die den gesamten Organismus in Mitleidenschaft zieht.
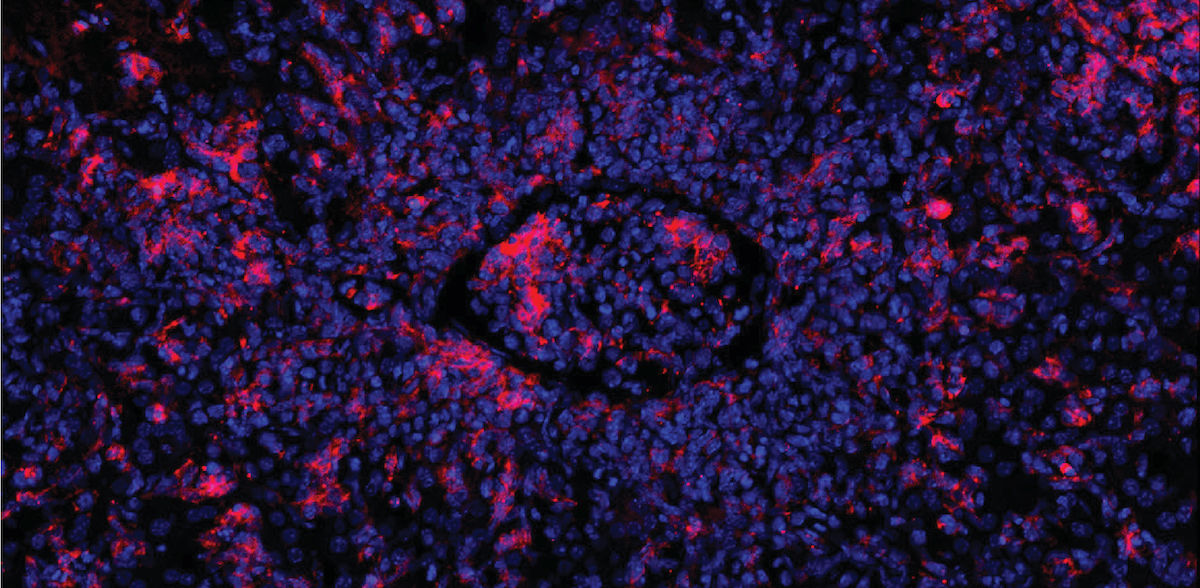
„Zur Behandlung kombinieren Ärzte Chemotherapie, Immunsuppression und Knochenmarkstransplantation. Trotzdem sterben viele der erkrankten Kinder“, sagt Professor Klaus Rajewsky, Leiter der Arbeitsgruppe „Immunregulation und Krebs“ am Max Delbrück Center. Gemeinsam mit seinem Team hat er ein neues Therapieprinzip entwickelt. Den Forschenden ist es gelungen, defekte T-Zellen von Mäusen sowie von zwei betroffenen Babys mit Hilfe der Genschere CRISPR-Cas9 zu reparieren. Die reparierten zytotoxischen T-Zellen funktionierten danach normal. Die erkrankten Mäuse erholten sich von der Hämophagozytischen Lymphohistiozytose.
Bei Mäusen funktioniert die Reparatur
Ausgangspunkt für die Arbeit waren Mäuse, bei denen das Team EBV-Infektionen nachstellen kann. Bei diesen Tieren veränderten die Forschenden ein Gen namens Perforin derart, dass es seine Funktion einbüßte – ein häufiger Gendefekt bei FHL-Betroffenen. Lösten sie nun einen Zustand ähnlich einer EBV-Infektion aus, vermehrten sich befallene B-Zellen unkontrolliert, weil die defekten zytotoxischen T-Zellen sie nicht beseitigen konnten. In der Folge schoss die Immunantwort über und die Mäuse erkrankten an Hämophagozytischer Lymphohistiozytose.
Aus dem Blut der Mäuse gewann das Team anschließend T-Gedächtnis-Stammzellen, also langlebige T-Zellen, aus denen aktive zytotoxische T-Zellen heranreifen. Die Forschenden reparierten mithilfe der Genschere CRISPR-Cas9 das defekte Perforin-Gen der T-Gedächtniszellen und spritzten sie den Tieren. Die Immunantwort beruhigte sich, und die Mäuse erholten sich von ihren Symptomen.
Wie lange der schützende Effekt anhält, ist ungewiss
Ob das Prinzip auch bei Menschen funktioniert, prüfte der Erstautor der Studie, Dr. Xun Li, mithilfe von Blutproben zweier erkrankter Säuglinge. Eines der Kinder hatte ein defektes Perforin-Gen, beim zweiten war ein anderes Gen betroffen. „Unser Genreparaturverfahren ist präziser als frühere Ansätze und die T-Zellen sind nach der Genreparatur nahezu unverändert“, sagt Li. „Zudem war es faszinierend, wie effektiv sich selbst aus einer geringen Blutmenge die T-Gedächtniszellen vermehren und reparieren ließen.“ Den Experimenten in Zellkulturen zufolge waren die reparierten T-Gedächtniszellen der Babys zu einer normalen zytotoxischen T-Zell-Antwort fähig.
Das Wirkprinzip funktioniert also grundsätzlich. Bevor es Betroffenen zugutekommen kann, muss das Team noch offene Fragen klären und das Behandlungskonzept in klinischen Studien prüfen. „Noch ist ungewiss, wie lange der schützende Effekt anhält“, sagt Dr. Christine Kocks, Wissenschaftlerin in Rajewskys Team. „Da die T-Gedächtnisstammzellen lange im Körper bleiben, hoffen wir auf einen langfristigen oder sogar dauerhaften Schutz. Es ist auch denkbar, den Betroffenen ihre reparierten T-Zellen immer wieder zu verabreichen.“
Durch die geringfügige Blutentnahme ist das Vorgehen schonend, und bei den Mäusen war keine vorbereitende Behandlung notwendig – anders als beispielsweise bei einer Knochenmarkstransplantation, sagt Rajewsky: „Wir hoffen sehr, dass unser Wirkprinzip ein Durchbruch für die Behandlung von Patienten mit FHL ist – entweder um Zeit für eine erfolgreiche Knochenmarkstransplantation zu gewinnen, oder sogar als Therapie selbst.
Originalveröffentlichung
Xun Li, Tristan Wirtz, Timm Weber, Mikhail Lebedin, Elijah D. Lowenstein, Thomas Sommermann, Andreas Zach, Tomoharu Yasuda, Kathrin de la Rosa, Van Trung Chu, Johannes H. Schulte, Ingo Müller, Christine Kocks, Klaus Rajewsky; "Precise CRISPR-Cas9 gene repair in autologous memory T cells to treat familial hemophagocytic lymphohistiocytosis"; Science Immunology, Volume 9