Durch Licht angetriebene Mikroben sind chemische Superfabriken
Neue Methode ermöglicht es Bakterien, Licht als externe Energiequelle zu nutzen, um die Bioproduktion von Zielverbindungen zu beschleunigen, ohne den natürlichen Stoffwechsel des Wirtsmikroorganismus zu stören
Anzeigen
Teilen ist der Schlüssel zum Leben in der Gesellschaft, sei es bei Kleinkindern, die sich Spielzeug teilen, oder bei Nationen, die sich natürliche Ressourcen teilen; aber es lässt sich nicht vermeiden, dass die eine Seite mehr bekommt und die andere weniger. Jetzt haben Forscher der Universität Osaka in Zusammenarbeit mit der Universität Shizuoka und der Universität Kobe einen Weg gefunden, die Notwendigkeit des Teilens von Energie bei der Bioproduktion zu umgehen, so dass die zellulären Wege, die für die Erzeugung des Produkts zuständig sind, immer mehr bekommen.
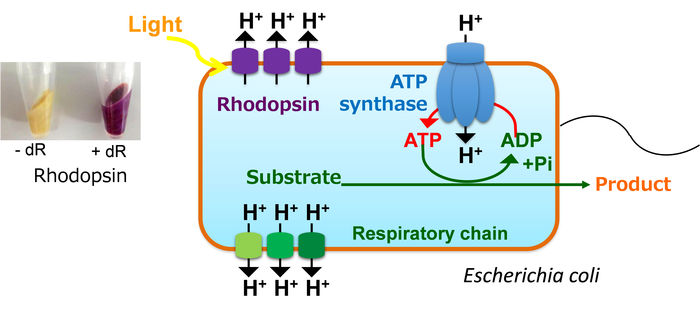
In der Regel pumpt E. coli Protonen durch die Atmungskette in den extrazellulären Raum, wobei es Kohlenstoffatome im TCA-Zyklus verbraucht, produziert ATP durch ATP-Synthase unter Verwendung des erzeugten Protonengradienten durch die Membran und treibt verschiedene Stoffwechselaktivitäten unter Verwendung des ATP an. Im Gegensatz dazu kann unser gentechnisch verändertes E. coli, das Rhodopsin exprimiert, Protonen mit Hilfe von Lichtenergie pumpen und ATP produzieren, ohne Kohlenstoffatome als CO2 zu verlieren. Daher kann die Zelle effektiv einige nützliche Chemikalien produzieren, die ATP für die Synthese benötigen.
Kiyotaka Y. Hara
In einer Studie, die kürzlich in der Zeitschrift Metabolic Engineering veröffentlicht wurde, haben die Forscher gezeigt, dass Mikroorganismen so manipuliert werden können, dass sie Licht als Energiequelle nutzen und damit zelluläre Ressourcen für die Herstellung von Bioprodukten freisetzen.
Metabolisch manipulierte Mikroorganismen werden weltweit zur Herstellung verschiedener nützlicher Chemikalien verwendet, aber es gibt einen Haken: Sowohl das mikrobielle Wachstum als auch die chemische Synthese benötigen ein Molekül namens ATP als Energiequelle. Wenn die zellulären "Fabriken" gesund gehalten werden, wird die chemische Produktion eingeschränkt.
"Mikroorganismen, die nützliche Substanzen produzieren, werden in der Regel entwickelt, indem der Stoffwechsel so verändert wird, dass Energie, die normalerweise für das Wachstum verwendet wird, in eine Ressource für die Synthese dieser Zielsubstanzen umgewandelt wird", erklärt Yoshihiro Toya, Erstautor der Studie. "Wir dachten, dass wir stattdessen Licht, eine externe Energiequelle, nutzen könnten, um die Produktion nützlicher Substanzen zu verbessern, ohne den natürlichen Stoffwechsel der Mikroorganismen zu stören.
Um dies zu testen, schleusten die Forscher ein heterologes Membranprotein namens Rhodopsin in Escherichia coli ein, einen in der Bioproduktion häufig verwendeten Mikroorganismus. Rhodopsin ist eine Pumpe, die durch Licht aktiviert wird, und die Wirkung der Pumpe führt zur Erzeugung von ATP, ohne dass die natürliche Maschinerie der Zelle (der so genannte TCA-Zyklus und die Atmungskette) zu dessen Herstellung genutzt wird. Dieser Ansatz hat den zusätzlichen Vorteil, dass die Emission von Kohlendioxid, einem Nebenprodukt des TCA-Zyklus, reduziert wird.
"Die Ergebnisse zeigen deutlich den Erfolg unserer Strategie", erklärt Kiyotaka Y. Hara, Leiter des Projekts. "Die Zellen, die Rhodopsin exprimieren, erzeugten deutlich mehr chemische Produkte, wenn sie dem Licht ausgesetzt wurden, und der Kohlenstofffluss in diesen Zellen wurde von der Energieerzeugung weg und hin zur chemischen Synthese gelenkt."
Nachdem sie bewiesen hatten, dass dieses Konzept für verschiedene Verbindungen wie 3-Hydroxypropionat, Mevalonat und Glutathion funktionierte, kreierten die Forscher drei neue Stämme von E. coli. Einer dieser Stämme exprimierte Super-Rhodopsine mit einer noch besseren Pumpleistung als das ursprünglich getestete Rhodopsin; dieser Stamm wurde von der Gruppe von Dr. Toya an der Universität Osaka entwickelt. Die beiden anderen Stämme enthielten synthetische biologische Systeme, die eine intrinsische Versorgung mit Retinal, dem Aktivator von Rhodopsin, gewährleisteten und die ausgewogene Expression mehrerer Gene im relevanten Stoffwechselweg optimierten; diese Stämme wurden von der Gruppe von Dr. Jun Ishii an der Universität Kobe entwickelt. Schließlich integrierte die Gruppe von Dr. Hara an der Universität Shizuoka alle diese Systeme in einen einzigen E. coli-Stamm , der eine Chemikalie in Abhängigkeit vom Licht produziert.
"Unsere Ergebnisse deuten darauf hin, dass biologisch hergestellte Mikroorganismen, die so konzipiert sind, dass sie Licht als Energiequelle nutzen, zur effizienten Biosynthese nützlicher Zielverbindungen verwendet werden können", so Hara.
Es wird erwartet, dass dieser neue Ansatz die Effizienz der Herstellung nützlicher Materialien durch Fermentation und andere Bioprozesse erhöht und gleichzeitig die Kohlenstoffemissionen reduziert.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.