Neue Erkenntnisse über die Recyclingfabriken der Zellen
Anzeigen
Wie kleine Müllschlucker säubern Organellen die Zellen von überflüssigem oder defektem Material. Welche Mechanismen dahinterstecken, finden Forscher gerade heraus.

Harald Platta (links) und Fahid Boutouja erforschen die Transportprozesse, die in Zellen ablaufen.
© RUB, Marquard
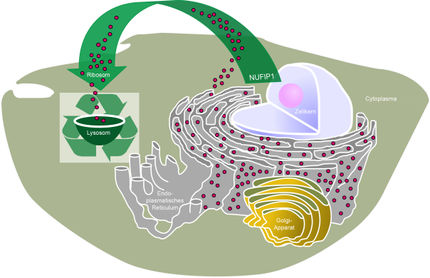
Die Zellen sowohl von Tieren als auch von Pflanzen sind darauf angewiesen, dass sie von ihrem eigenen beschädigten oder überflüssigen Zellmaterial befreit werden – ein Vorgang, den man Autophagozytose nennt. Den Abbau der Substrate übernehmen Proteine. Er findet bei Tieren in einem Zellorganell namens Lysosom und bei Pflanzen und Hefen in der Vakuole statt. Die Abbauproteine selbst befinden sich nicht von Anfang an in der Vakuole oder im Lysosom, sondern müssen zunächst von Transportrezeptoren auf kleinen Vesikeln zu ihrer Wirkungsstätte gebracht werden.
Wie unersetzlich der Transportrezeptor Vps10 für diese Aufgabe ist, konnte das Team der Arbeitsgruppe Biochemie Intrazellulärer Transportprozesse der Ruhr-Universität Bochum (RUB) von Dr. Harald Platta jetzt zeigen.
In einer zweiten Studie analysierten die Wissenschaftler das Protein Vac8, welches die Fusion von kleinen und großen Vesikeln mit der vakuolären Membran reguliert, damit die jeweilige Fracht in das Innere der Vakuole entlassen werden kann.
Unersetzlich für den Abbau komplexer Substrate
Die Forscher konnten zeigen, dass der Transportrezeptor Vps10, welcher bei Pflanzen und Hefen das Abbauprotein Pro-Pep4 vom Endoplasmatischen Retikulum zur Vakuole dirigiert, nicht einer unter mehreren austauschbaren Rezeptoren ist. „Vps10 trägt vielmehr durch den effektiven Transport von Pro-Pep4 entscheidend zu der Aktivität der Vakuole während des Abbaus der zelleigenen Bestandteile bei“, so Harald Platta.
Ohne Vps10, dessen Ebenbild in menschlichen Zellen Sortillin heißt, könne Pro-Pep4 nicht effizient zur Vakuole gebracht und dort zu Pep4, das bei Menschen Cathepsin D heißt, aktiviert werden.
Während der Abbau von einzelnen kleinen Proteinen und Ribosomen in der Vakuole auch ohne Vps10 noch möglich ist, zeigte sich, dass der Abbau von komplexen Substraten, wie Peroxisomen oder Mitochondrien, ohne Vps10 nicht mehr effektiv erfolgen kann und mit einer Fehlsteuerung und damit ineffizienten Reifung von Pro-Pep4 einhergeht.
Weitreichende Auswirkungen
„Die Erkenntnisse aus dieser Studie sind auch für weitergehende Fragen relevant“, erklärt Platta. „So hängt es im Wesentlichen von Pep4 ab, wie giftig verschiedene für Pflanzen schädliche Pilze sind. Darüber hinaus schützt Pep4 Hefezellen vor der spontanen Bildung von Prionen, speziellen schädlichen Eiweißpartikeln, während der Verlust der Pep4-Aktivität zu einer verkürzten Lebensdauer führt. In Säugern führt ein Mangel des gereiften Pep4-Homologs Cathepsin D zu neurodegenerativen Störungen. Und die Fehlsteuerung von Pro-Cathepsin D wurde bei verschiedenen Krebsformen beobachtet.“
Die Membranen von Vesikel und Vakuole müssen miteinander fusionieren
Die zweite Studie analysierte das Protein Vac8, welches eng verwandt mit den Säuger-Proteinen Plakoglobin, einem Tumorsuppressor, und Katenin ist. Während letztere an der Plasmamembran Zell-Zell-Kontakte vermitteln, reguliert Vac8 innerhalb der Zelle die Fusion der Membranen von Transport-Vesikeln mit der vakuolären Membran. Dabei handelt es sich entweder um kleine Vesikel, die Abbauproteine enthalten, oder große Vesikel, die mit den abzubauenden Substraten beladen sind.
Die Fusion der Membranen scheint nicht, wie man annehmen würde, über die Bindung zu anderen Proteinen zu erfolgen, sondern, wie die Forscherinnen und Forscher zeigen konnten, über die Koordination von Lipiden. „In der Studie konnten wir darstellen, dass in Vac8-defizienten Zellen die Fusion und die abbauende Aktivität der Vakuole durch die experimentelle Zugabe von den Membranlipid-Bausteinen Ölsäure und Glycerin regeneriert werden konnte“, sagt Harald Platta. Daher nimmt Vac8 nach Meinung der Wissenschaftler eine zentrale Rolle bei der Autophagozytose von allen getesteten Substraten – zytosolische Proteine, Ribosomen, Peroxisomen – ein.
Vac8 scheint somit nicht nur als einfaches Adapter-Molekül zwischen zwei Membranen zu agieren, sondern mag womöglich auch die Zusammensetzung der umliegenden Lipide definieren, um den Kontakt der beiden Membranen vorzubereiten. „Dies wirft interessante neue Fragestellungen zur Identität der beteiligten Lipidtypen auf“, gibt Harald Platta einen Ausblick auf zukünftige Forschungsfragen.
Originalveröffentlichung
Fahd Boutouja, Christian M. Stiehm, Thomas Mastalski, Rebecca Brinkmeier, Christina Reidick, Fouzi El Magraoui, Harald W. Platta; "Vps10-mediated targeting of Pep4 determines the activity of the vacuole in a substrate-dependent manner"; Scientific Reports; 2019
Fahd Boutouja, Christian M. Stiehm, Christina Reidick, Thomas Mastalski, Rebecca Brinkmeier, Fouzi El Magraoui, Harald W. Platta; "Vac8 controls vacuolar membrane dynamics during different autophagy pathways in Saccharomyces cerevisiae"; Cells; 2019