Nuevos hallazgos sobre los centros de reciclaje de células
Al igual que los pequeños vertederos de basura, ciertos orgánulos limpian las células de material superfluo o defectuoso. Los investigadores están estudiando actualmente los mecanismos que subyacen a este proceso.

Harald Platta (izquierda) y Fahid Boutouja investigan los procesos de transporte que tienen lugar en las células.
© RUB, Marquard
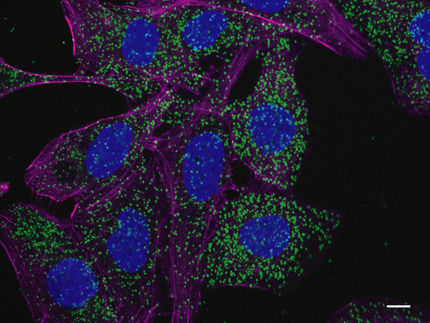
Tanto las células animales como las vegetales dependen de la eliminación de su propio material celular dañado o superfluo, un proceso que se conoce como autofagia. La degradación de los sustratos se realiza mediante proteínas. En los animales, tiene lugar en un organillo celular llamado lisosoma y en las plantas y levaduras en la vacuola. Inicialmente, las proteínas de degradación no se encuentran en la vacuola o lisosoma, sino que deben ser transportadas por receptores de transporte en pequeñas vesículas a su sitio de acción.
El equipo del grupo de investigación Bioquímica del Transporte Intracelular de la Ruhr-Universität Bochum (RUB), dirigido por el Dr. Harald Platta, ha demostrado con éxito lo indispensable que es el receptor de transporte Vps10 para el proceso.
En un segundo estudio, los investigadores analizaron la proteína Vac8, que regula la fusión de vesículas pequeñas y grandes con la membrana de la vacuola para que la carga respectiva pueda ser liberada en el interior de la vacuola.
Indispensable para la degradación de sustratos complejos
Los investigadores demostraron que el receptor de transporte Vps10, que en plantas y levaduras dirige la proteína de degradación Pro-Pep4 desde el retículo endoplásmico a la vacuola, no es sólo uno de varios receptores intercambiables. "Más bien, el Vps10 contribuye significativamente a la actividad de la vacuola durante la degradación de los propios componentes de la célula al transportar eficazmente el Pro-Pep4", dice Harald Platta.
Sin el Vps10, cuya contraparte en las células humanas se llama sortilina, el Pro-Pep4 no puede ser transportado eficientemente a la vacuola y activado a Pep4, que se llama catepsina D en humanos.
Mientras que la degradación de las pequeñas proteínas y ribosomas ocasionales en la vacuola sigue siendo posible sin Vps10, se ha puesto de manifiesto que la degradación de sustratos complejos, como peroxisomas o mitocondrias, ya no puede tener lugar de forma efectiva sin Vps10 y está asociada a un mal funcionamiento y, por lo tanto, a una maduración ineficiente de Pro-Pep4.
Consecuencias de gran alcance
"Los hallazgos de este estudio también son relevantes para las preguntas de seguimiento", explica Platta. "Pep4 determina, por ejemplo, la toxicidad de varios hongos que son dañinos para las plantas. Además, Pep4 protege las células de levadura de la formación espontánea de priones, es decir, de partículas proteicas nocivas específicas, mientras que la pérdida de la actividad de Pep4 reduce su vida útil. En mamíferos, una deficiencia de la catepsina D de homólogo maduro de Pep4 conduce a trastornos neurodegenerativos. Y el mal funcionamiento de la pro-cathepsina D se ha observado en varias formas de cáncer".
Las vesículas y las membranas de las vacuolas deben fusionarse entre sí.
El segundo estudio analizó la proteína Vac8, que está estrechamente relacionada con las proteínas de los mamíferos plakoglobina, un supresor tumoral, y catenina. Mientras que estos últimos median los contactos célula-célula en la membrana plasmática, Vac8 regula la fusión de las membranas de las vesículas de transporte con la membrana vacuolar dentro de la célula. Se trata de pequeñas vesículas que contienen proteínas de degradación o de grandes vesículas cargadas con los sustratos que van a ser degradados.
Contrariamente a lo que se podría suponer, la fusión de las membranas no parece tener lugar mediante la unión a otras proteínas, sino, como han demostrado los investigadores, mediante la coordinación de los lípidos. "En el curso del estudio, pudimos demostrar que la fusión y la actividad degradante de la vacuola en células con deficiencia de Vac8 podían regenerarse mediante la adición experimental de los bloques de construcción de lípidos de la membrana, ácido oleico y glicerol", dice Harald Platta. Según los investigadores, esta es la razón por la que Vac8 desempeña un papel crucial en la degradación autofágica de todos los sustratos probados: proteínas citosolicas, ribosomas y peroxisomas.
En consecuencia, Vac8 no sólo parece actuar como una simple molécula adaptadora entre dos membranas, sino que también puede definir la composición de los lípidos circundantes para preparar el contacto entre las dos membranas. "Esto plantea nuevas e interesantes preguntas sobre la identidad de los tipos de lípidos implicados", ya que Harald Platta esboza posibles preguntas de investigación futuras.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Fahd Boutouja, Christian M. Stiehm, Thomas Mastalski, Rebecca Brinkmeier, Christina Reidick, Fouzi El Magraoui, Harald W. Platta; "Vps10-mediated targeting of Pep4 determines the activity of the vacuole in a substrate-dependent manner"; Scientific Reports; 2019
Fahd Boutouja, Christian M. Stiehm, Christina Reidick, Thomas Mastalski, Rebecca Brinkmeier, Fouzi El Magraoui, Harald W. Platta; "Vac8 controls vacuolar membrane dynamics during different autophagy pathways in Saccharomyces cerevisiae"; Cells; 2019