Una parada indispensable para la copiadora de genes
Cómo una proteína ayuda a hacer copias limpias de los genes
El complejo enzimático que lee los genes lleva otros factores "a cuestas" a lo largo del ADN hasta su destino. La proteína BRD4 es esencial para este proceso: los factores se acoplan a la proteína durante una pausa de la lectura. La interacción también permite a la célula intervenir en el proceso.
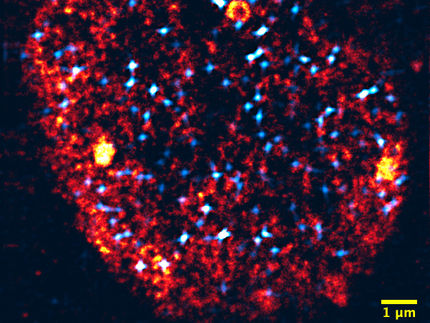
Impresión artística basada en datos experimentales de un método de detección de moléculas de ARN polimerasa en segmentos de genes. En la mitad superior de la imagen predomina la nube azul de puntos, que simboliza una pérdida general de la polimerasa a lo largo de los genes. La mitad inferior muestra los resultados de un método de detección más antiguo, que no pudo revelar estos cambios.
Annkatrin Bressin MPI f. molek. Genet.
Hay un largo camino desde la información genética hasta un rasgo reconocible. Para que los genes den lugar a estructuras proteínicas o incluso controlen el desarrollo de todo un organismo, tienen que suceder una serie de acontecimientos en el orden correcto. En primer lugar, la célula tiene que leer el gen desde el ADN ("transcripción"): envía un complejo enzimático a lo largo del ADN, generando una copia de trabajo del gen en forma de ARN. Pero poco después del inicio, la enzima copiadora ya se detiene de nuevo.
Durante esta parada, el complejo formado por la ARN polimerasa y varias proteínas auxiliares recoge otras enzimas y factores. Éstos se encargan de que la máquina copiadora de genes pueda continuar su recorrido a lo largo del ADN para que la molécula de ARN recién generada se procese correctamente al final. La proteína BRD4 desempeña un papel esencial en este proceso. Se une a las moléculas implicadas y ayuda a transportarlas al lugar del gen donde se necesitan. Así lo ha descubierto un equipo de investigación dirigido por Andreas Mayer, del Instituto Max Planck de Genética Molecular (MPIMG) de Berlín, y lo ha publicado en la revista Molecular Cell.
Observar las consecuencias de una perturbación precisa
"Muchos laboratorios de todo el mundo estudian actualmente el BRD4 como diana farmacológica, principalmente porque está implicado en el desarrollo de varios tipos de cáncer, incluidos los carcinomas", afirma Mayer. "Nuestro objetivo era descubrir las funciones fundamentales de BRD4 en la transcripción y en el procesamiento posterior del ARN en las células humanas".
Para descifrar el funcionamiento de BRD4, el grupo de investigación Max Planck estudió la proteína en cultivos de células humanas. Los científicos utilizaron un nuevo método que les permitió eliminar selectivamente todas las moléculas de BRD4 de las células en sólo dos horas, sin afectar a otras proteínas.
"Seguimos el principio de intervenir muy rápida y específicamente en el nivel de la proteína, al tiempo que medimos el impacto inmediato en la célula con una resolución temporal comparable, mucho antes de que todo se difumine por las respuestas al estrés", dice Mayer. "En otras palabras, echamos un cable y observamos directamente lo que ocurre, y no sólo cuando la máquina se ha parado".
Atascado a mitad de camino
Los investigadores observaron cómo reaccionaba la célula ante la pérdida inmediata de la proteína BRD4 y, a intervalos cortos de tiempo, secuenciaron las moléculas de ARN recién generadas.
"Pudimos ver cómo la transcripción disminuía de forma global y uniforme", afirma Mirjam Arnold, estudiante de doctorado del equipo de Andreas Mayer y primera autora de este trabajo. La razón era que el complejo de la ARN polimerasa permanecía mucho más tiempo en la región aguas abajo del inicio del gen y era menos detectable en el resto del gen. Al parecer, estaba atascado.
"En los organismos multicelulares, es normal que la ARN polimerasa se inicie y vuelva a hacer una pausa después de 50 a 100 nucleótidos, esperando antes de continuar", dice Arnold. "La polimerasa hizo una pausa mucho más larga de lo normal y parecía estar masivamente limitada en su actividad".
Sobrepasar la línea de meta
Además, el complejo enzimático navegó mucho más allá de la línea de meta en al menos el 40 por ciento de los genes detectados y copió varios miles de nucleótidos más de ADN de la zona aguas abajo del gen real. Como consecuencia, generó moléculas de ARN extendidas, muchas de las cuales estaban formadas por un sinsentido y tenían la capacidad potencial de causar estragos en la célula.
"Fue una gran sorpresa ver este efecto de lectura", dice Annkatrin Bressin, también estudiante de doctorado y primera autora del estudio. "El complejo enzimático carecía de frenos, por así decirlo, y no era capaz de detenerse. Además, el ARN no se procesaba correctamente".
Como resultado, el ARN seguía unido al complejo de la polimerasa y no se escindía y separaba como se suponía. Los pasos de procesamiento posteriores, como la poliadenilación, en la que las enzimas añaden una cola de hasta 250 bloques de construcción de adenina al final del ARN, también se vieron perjudicados.
Efectos en los extremos opuestos del gen
Estos fenómenos causados por la rápida eliminación de BRD4 desconcertaron a los científicos. ¿Qué relaciona los efectos observados en los extremos opuestos del mismo gen? Una búsqueda por espectrometría de masas de las moléculas que interactúan con BRD4 a lo largo del tiempo proporcionó una explicación. Los experimentos se llevaron a cabo en colaboración con David Meierhofer, del MPIMG, que es un especialista en este tipo de análisis.
Al parecer, la ARN polimerasa se une a BRD4 y espera señales adicionales durante la parada inicial no muy lejos de la región de inicio. Estas señales vienen en forma de factores de elongación, proteínas que animan a la polimerasa a continuar su trabajo. Si faltan, la transcripción no puede continuar. BRD4 parece ayudar a "reclutar" estos factores de elongación y permitir la síntesis productiva de ARN.
En particular, ya en esta fase temprana, los llamados factores de procesamiento de ARN entran en contacto con BRD4. Se trata de más de una docena de proteínas que convierten la molécula de ARN transcrita en su estado final. La ARN polimerasa las lleva a cuestas hasta su lugar de acción. Si faltan estos factores de procesamiento, el complejo de la polimerasa genera moléculas de ARN alargadas, que pueden incluso perjudicar a la célula.
Tornillos de ajuste para sistemas de control complejos
"BRD4 parece ser esencial para el ensamblaje de un complejo enzimático funcional capaz de producir ARN", afirma Mayer. "Esta proteína es claramente uno de los pomos de control centrales para la fase de elongación, durante la cual la cadena de ARN se ensambla nucleótido a nucleótido".
No sólo el inicio de la transcripción del gen, conocido como fase de iniciación, es una forma de controlar la actividad de un gen, dice Mayer. La célula también puede regular la extensión del transcrito de ARN y los procesos al final de los genes que informan al complejo de la polimerasa dónde debe detenerse. Si es necesario, puede detenerse o terminar en una fase posterior.
Conocer mejor las funciones celulares de BRD4 también podría servir para desarrollar aplicaciones terapéuticas. "Se ha observado que BRD4 desencadena y mantiene circuitos reguladores de genes que están implicados en el desarrollo del cáncer, razón por la cual BRD4 ha surgido como objetivo terapéutico. Pero la función exacta de la proteína y su mecanismo de acción no estaban claros", afirma el científico. "Ahora que entendemos mejor el propósito de la proteína, esta ganancia de conocimiento podría acercar a los investigadores al objetivo final de desarrollar estrategias terapéuticas que intervengan con mayor precisión, haciéndolas más efectivas y causando menos efectos secundarios."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.